随着生活水平提高和饮食结构改变,急性高甘油三酯血症胰腺炎(acute hypertrigly ceridemic pancreatitis)的发病率逐年上升。高甘油三酯血症(hypertriglyceridemia, HTG)已成为继胆源性因素之后,急性胰腺炎(acute pancreatitis, AP)的第二大病因[1]。HTG-AP易反复发作,其复发率显著高于其他病因引起的AP。复发性HTG-AP患者较首次发病患者具有更高的脏器功能衰竭和局部并发症的风险[2-3]。此外,HTG-AP反复发作,可进展为慢性胰腺炎,导致患者长期腹痛、营养不良、糖尿病,显著降低患者生存质量,给个人、家庭、社会带来沉重负担[4]。
目前,国内外指南和共识多聚焦于HTG-AP急性期的治疗,而对于康复期如何规范管理以提高患者生存质量、防止复发,尚无相关指南或共识。虽然已有较多关于HTG调控的共识,但其主要目标是防治心血管事件,而非针对预防HTG-AP复发。为此,本共识针对HTG-AP康复期患者AP复发的预防,并发症、合并症的防治等关键问题进行讨论。旨在为临床医务人员提供HTG-AP康复期患者规范化管理的建议,以降低复发率,改善患者预后。
1 共识制定的方法 1.1 文献检索工作组系统检索了PubMed、Web of Science、Cochrane Library、中国知网和万方数据库。中文检索词包括“高甘油三酯血症”“急性胰腺炎”,英文检索词包括“hypertriglyceridemia”“acute pancreatitis”等,检索时间范围为建库至2025年7月。文献检索完成后,工作组进行文献筛查,对纳入文献进行质量评价及证据汇总。共识依据美国牛津循证医学中心(Oxford Centre for Evidence Based Medicine)的证据分级标准对证据进行分级。
1.2 共识制定方法共识制定采用共识会议法。我们组织国内急诊医学、重症医学、普通外科、消化医学、影像学、中西医结合医学、营养学等多学科专家成立专家组。基于文献检索获得的HTG-AP康复期管理循证医学证据,结合专家组的临床经验和我国国情,通过线上会议、现场讨论和投票等方式,对推荐意见进行多轮修订。最终,根据专家推荐强度将意见划分为强烈推荐、中等强度推荐和弱推荐3个维度,形成本共识。共识通过国际实践指南注册与透明化平台(practice guideline registration for transparency, PREPARE)进行注册,注册号:PREPARE-2025CN678。循证证据等级和推荐强度分级见表 1和表 2。
| 证据等级 | 分级释义 |
| Ⅰ级 | 来自多个随机对照试验或Meta分析的数据 |
| Ⅱ级 | 来自单个随机对照试验或大样本非随机研究的数据 |
| Ⅲ级 | 来自回顾性研究或个案研究的数据 |
| Ⅳ级 | 专家意见(包括描述性综述) |
| 推荐强度 | 等级释义及临床建议 |
| 强烈推荐 | 循证证据肯定或者良好(Ⅰ~Ⅱ级);或循证证据一般(Ⅲ~Ⅳ级),但在国内外指南中明确推荐;能够改善健康结局,利大于弊 |
| 中等强度推荐 | 循证证据一般(Ⅲ~Ⅳ级),可以改善健康结局 |
| 弱推荐 | 循证证据不足或矛盾;无法明确利弊,但可能改善健康结局 |
近年来我国HTG-AP的发病率显著上升,占所有AP病例的7.8%~25.6%[5-8]。HTG-AP的发病人群多为40岁以下的中青年男性[3, 9],与代谢综合征、高脂饮食、缺乏运动等不良生活习惯密切相关。地域分布差异明显,经济发达地区发病率较高,这与饮食结构西化相关[10-13]。HTG-AP首次发作后复发率可达16%~32%[12],首次发作后18个月累积复发率达22%,复发患者生活质量显著下降[14]。其复发与持续脂质代谢紊乱密切相关。研究发现,HTG-AP复发的高危因素包括男性、吸烟、饮酒、糖尿病、甘油三酯(triglycerides, TG)代谢相关基因变异以及HTG-AP反复发作史[3, 15-16],这些因素共同作用,影响脂质代谢[17]。其中,血清TG峰值水平过高和TG长期控制不达标已被确认为HTG-AP复发的独立危险因素[18]。
2.2 诱发HTG-AP的HTG有哪些类型?推荐意见1:根据病因,将诱发HTG-AP的HTG类型分为原发性HTG和继发性HTG。原发性HTG以遗传性脂代谢缺陷为核心,主要包括Ⅰ型、Ⅳ型和Ⅴ型高脂蛋白血症。而继发性HTG多与代谢性疾病、药物、妊娠及不良生活方式相关。明确病因有助于制定个体化干预策略,降低复发风险。(Ⅱ级,强烈推荐)
依据HTG的病因及临床特点可将HTG分为原发性与继发性两类。原发性HTG主要由遗传性脂蛋白代谢异常引起,其核心机制与脂蛋白脂肪酶(lipoprotein lipase, LPL)活性降低或相关调控蛋白功能缺陷相关。根据Fredrickson分型,与HTG-AP密切相关的原发性高脂蛋白血症主要包括Ⅰ型、Ⅳ型和Ⅴ型高脂蛋白血症[19]。Ⅰ型高脂蛋白血症(家族性乳糜微粒血症):由LPL基因突变或ApoC-Ⅱ缺陷导致乳糜微粒(chylomicron, CM)清除障碍,血清TG显著升高,易诱发胰腺炎[18]。Ⅳ型高脂蛋白血症(家族性高甘油三酯血症):表现为极低密度脂蛋白(very low-density lipoprotein, VLDL)水平升高,TG水平常波动于5.6~10 mmol/L,是HTG-AP最常见的遗传类型。Ⅴ型高脂蛋白血症(混合型高脂血症):多有遗传因素叠加继发性因素(糖尿病、肾病、酗酒)引发,兼有CM和VLDL升高,胆固醇升高,复发风险较高[19-20]。此外,遗传因素如CFTR基因突变、ANGPTL3基因异常等也可能通过影响脂质代谢通路增加HTG-AP风险[21]。继发性HTG多由代谢性疾病(如糖尿病、肥胖、甲状腺功能减退症等)[22]、药物(如糖皮质激素、雌激素、抗精神病药物等)[23]、不良生活方式[3, 16]及妊娠[24-25]引发。这些因素通过促进脂肪合成或抑制LPL活性,导致TG升高。
2.3 引起HTG-AP复发的混合性因素有哪些?推荐意见2:部分HTG-AP患者除HTG外还可能合并存在胆石症、饮酒、Oddi括约肌功能障碍、胰胆管汇流异常、胰腺分裂、胰腺微小肿瘤等隐匿病因,其中,胆-脂复合型因素在临床中最为常见。(Ⅱ级,强烈推荐)
除HTG外,部分HTG-AP患者还同时存在胆道结石、饮酒等其他病因。胆道结石是HTG-AP常见混合性病因之一[12],此类患者的病情通常较单一因素引发的急性胰腺炎更为严重[26]。饮酒也是HTG-AP复发的重要混合性因素,约9%HTG-AP患者同时存在酒精性因素[18]。酒精不仅可直接损伤胰腺组织,还可通过干扰脂质代谢,升高TG水平,增加胰腺炎复发风险,提示脂-酒复合型病因在HTG-AP复发中的重要作用。此外,部分患者还可能存在Oddi括约肌功能障碍、胰胆管汇流异常、胰腺分裂、胰腺微小肿瘤等隐匿病因与HTG同时存在,导致AP的反复发作[27-28]。
2.4 如何明确HTG-AP复发的病因?推荐意见3:为避免患者血甘油三酯水平在发病后快速下降,建议实施“第一管血”策略(即拟诊AP时立即采集血液标本送检或冷藏备检),以提高HTG检出率。(Ⅳ级,中等强度推荐)
推荐意见4:对反复复发的HTG-AP患者,除常规检查外,应进一步完善EUS、ERCP或血脂基因检测等检查,以排除胆道微小结石、胆胰管合流异常、胰腺微小肿瘤等其他隐匿病因。(Ⅱ级,强烈推荐)
明确病因是防治HTG-AP复发的关键。需通过详细的病史采集(包括健康状况、饮食习惯、既往史、饮酒史、用药史及家族史)、体格检查、实验室及影像学检查(如腹部超声、CT)综合判断[29]。建议采用“第一管血”策略,即在拟诊AP时立即采血送检或冷藏备检,避免因延迟检测导致血清TG、胆红素等关键指标下降至诊断阈值以下,甚至降至正常水平,导致漏诊和误诊[30]。对疑似存在胆道结石或狭窄的患者,应完善磁共振胰胆管成像(magnetic resonance cholangiopancreatography, MRCP)检查[31]。若常规检查无法明确病因,可采用超声内镜(endoscopic ultrasound, EUS)进一步发现胆道微结石、胰腺变异等病变[32],结合细针穿刺活检技术还能提高肿瘤或自身免疫性胰腺炎的诊断率[33]。或通过内镜逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography, ERCP)可直接观察胰胆管解剖,完善Oddi括约肌测压等功能检查诊断功能障碍等病因,排除混合性因素[34]。此外,部分HTG-AP与LPL、ApoC-Ⅱ等基因突变相关,血脂基因检测有助于识别遗传因素,指导个体化治疗[35-37]。
2.5 HTG的管理策略 2.5.1 如何通过生活方式干预控制HTG?推荐意见5:生活方式干预是控制HTG、预防HTG-AP复发的基础性措施,核心内容包括严格戒烟、戒酒,饮食调整,规律运动和体重控制。(Ⅱ级,强烈推荐)
生活方式干预是HTG-AP康复期控制HTG和预防复发的基石,主要包括戒烟戒酒、饮食调整、规律运动及体重控制。(1)吸烟和饮酒均为HTG-AP复发的独立危险因素。酒精会直接升高TG并刺激胰腺;吸烟则加重胰腺细胞损伤、促进钙化和脂质过氧化[38-39]。(2)饮食方面,推荐低脂、低碳水化合物饮食[40],限制饱和脂肪酸和反式脂肪酸摄入,增加膳食纤维、低升糖指数食物、优质蛋白质及富含ω-3脂肪酸的食物。(3)规律运动可显著降低血清TG水平,降幅达7%~30%[22]。建议每周进行至少150 min中等强度运动(如快走、游泳)或75 min高强度运动(如跑步、跳绳)[41]。研究表明,每周跑步11~23 km可降低约20%的空腹TG,更高强度运动效果更佳[42]。(4)肥胖是HTG的重要危险因素。体重减轻5%~10%可使TG水平下降约20%,每减重1 kg约可降低TG 8 mg/dL[42]。建议将BMI维持在18.5~23.9 kg/m2的正常范围,合并糖尿病或胰岛素抵抗者更应积极减重[43]。此外,可借助智能穿戴设备辅助制定个性化饮食和运动计划,动态监测强度与能耗,帮助培养健康习惯,避免过度疲劳[44-45]。
2.5.2 HTG患者如何选择降脂药物治疗?推荐意见6:对于采取生活方式干预后,血清TG水平仍控制不佳的HTG患者,应及时启动降脂药物治疗。贝特类药物是降TG治疗的一线药物,如单药血脂控制不佳,可选择联合使用他汀类、处方级ω-3脂肪酸或烟酸等其他药物。(Ⅰ级,强烈推荐)
对于采取生活方式干预后,血清TG水平仍未达标的患者,需启动药物治疗。常用的降脂药物包括贝特类、他汀类、处方级ω-3脂肪酸、烟酸等。贝特类药物通过激活过氧化物酶体增殖物激活受体α(PPARα),促进LPL活性并减少载脂蛋白C-Ⅲ(ApoC-Ⅲ)合成发挥作用[46]。他汀类药物降低血清TG的作用较弱,通常不推荐作为单药疗法。但在重度HTG患者中,他汀类药物可与贝特类药物联合使用,以增强降脂效果,用药期间需警惕肝损伤和横纹肌溶解风险[47]。处方级ω-3脂肪酸通过抑制肝脏TG合成和降低CM及VLDL水平来降低血清TG,且不良反应较少,适用于需控制TG的妊娠期HTG患者[48]。红曲制剂含有天然他汀类成分,能全面调节血脂谱,可使血清TG水平降低约32% [49]。烟酸常导致皮肤潮红、血糖显著升高等不良反应,因此其在临床上应用逐渐减少[50]。常用降低TG药物见表 3。
| 药物种类 | 代表药物 | 用法用量 | 适应证 | 禁忌证 | 不良反应 |
| 贝特类 | 非诺贝特 | 0.2~0.3 g/d | HTG,低高密度脂蛋白血症,TG升高为主的混合型高脂血症 | 活动性肝病,胆囊疾病,严重肝肾功能受损,妊娠期或哺乳期妇女 | 肝酶升高,肌病,肾毒性 |
| 苯扎贝特 | 0.2~0.4 g/d | ||||
| 吉非贝特 | 1.2 g/d | ||||
| 佩玛贝特 | 0.2~0.4 g/d | ||||
| ω-3脂肪酸 | 处方级高纯度鱼油制剂 | 1.5~3.0 g/d | HTG,TG升高为主的混合型高脂血症 | 鱼油过敏,出血性疾病慎用,Ⅰ型高脂蛋白血症,严重糖尿病和肥胖患者慎用 | 消化道症状,轻度肝酶/肌酸激酶升高,出血倾向 |
| 烟酸 | 阿昔莫司 | 0.5~1.0 g/d | HTG,低高密度脂蛋白血症,TG升高为主的混合型高脂血症 | 严重肝病,严重痛风,溃疡病 | 颜面潮红,肝脏损害,高血糖,高尿酸血症,上消化道不适 |
| 烟酸缓释片 | 0.5~2 g/d | ||||
| 他汀类 | 阿托伐他汀 | 10~20 mg/d | 混合型高脂血症 | 胆汁淤积,活动性肝病或不明原因持续性肝生化异常;失代偿性肝硬化;妊娠及哺乳期妇女 | 肝脏转氨酶升高,肌痛,肌炎,横纹肌溶解,头痛,失眠,抑郁,消化不良等消化道症状 |
| 瑞舒伐他汀 | 5~10 mg/d | ||||
| 辛伐他汀 | 20~40 mg/d | ||||
| 普伐他汀 | 40 mg/d | ||||
| 氟伐他汀 | 20~40 mg/d | ||||
| 红曲制剂 | 血脂康 | 0.6~1.2 g/d | 高脂血症 | 成分过敏者,活动性肝炎或无法解释的血清氨基转移酶升高者 | 耐受性较好,常见不良反应为胃肠道不适 |
| 注:TG:甘油三酯,HTG:高甘油三酯血症 | |||||
基因治疗为遗传性HTG患者提供了新的治疗方向,其主要通过调控基因表达来降低血清TG水平。目前,基因治疗仍处于临床试验阶段,但已显示出良好的前景。(1)ApoC-Ⅲ抑制剂:Volanesorsen是一种ApoC-Ⅲ抑制剂,能够显著降低重度HTG患者的TG水平,并减少HTG-AP的复发风险[51]。Plozasiran是另一种ApoC-Ⅲ抑制剂,已在家族性乳糜微粒血症综合征患者中显示出良好的降脂效果[52]。(2)ANGPTL3抑制剂:Evinacumab是一种针对ANGPTL3的单克隆抗体,能够降低严重HTG患者的TG水平。目前已在美国获批,用于治疗家族性高胆固醇血症[53]。新型降脂药物及作用靶点见表 4。(3)LPL基因治疗:基于腺病毒载体(AAV1)递送功能型脂蛋白脂酶基因(LPLS447X)的疗法,在LPL缺乏症患者中显示出显著且持久的降脂效果[54]。
| 药物名称 | 治疗靶点 |
| Volanesorsen | ApoC-Ⅲ |
| Plozasiran | ApoC-Ⅲ |
| Evinacumab | ANGPTL3 |
| Vupanorsen | ANGPTL3 |
| 注:ApoC-Ⅲ:载脂蛋白C Ⅲ;ANGPTL3:血管生成素样蛋白3 | |
推荐意见7:目前对HTG-AP康复期患者的最佳血清TG控制目标尚有争议。推荐将血清TG < 5.6 mmol/L (500 mg/dL)作为基本目标,以降低HTG-AP复发风险。对于存在高危因素的患者,可进一步将血清TG强化控制至2.3 mmol/L (200 mg/dL)以下,甚至控制在正常范围以内(血清TG < 1.7 mmol/L (150 mg/dL))。(Ⅱ级,中等强度推荐)
HTG-AP的复发风险与TG水平密切相关,因此明确康复期TG控制目标对预防复发至关重要。多项国内外指南建议[55-57],当TG水平超过5.65 mmol/L(500 mg/dL)时应启动降脂治疗以预防胰腺炎发生或复发。研究表明,出院后血清TG > 5.6 mmol/L显著增加复发风险[58],且TG峰值> 33.9 mmol/L或近期TG > 5.6 mmol/L均为复发的独立危险因素[18]。因此,将TG控制在5.6 mmol/L以下是降低复发风险的基本目标。近年来,证据支持更严格的TG控制可进一步减少HTG-AP复发。一项前瞻性研究显示,即使TG处于中度升高水平(2.26~5.65 mmol/L),复发风险仍为达标者的5.47倍,强调将TG降至 < 2.26 mmol/L的重要性[58]。对于高危患者,如合并家族性高甘油三酯血症、代谢综合征、糖尿病、酗酒或药物诱发者,建议将TG控制在 < 1.7 mmol/L的正常范围,并加强随访[59]。但也应警惕过度降脂可能带来的不良反应及经济负担[60],强调个体化治疗与风险效益评估。
2.7 如何处置降脂药物引起的肝损伤和肌肉损伤?推荐意见8:使用降脂药物期间出现肝损伤和肌肉损伤,在排除其他原因引起之后,对于轻度肝损伤(AST和ALT升高<3倍ULN),建议在监测下减量用药并予以护肝治疗,对于AST或ALT升高>3倍ULN或出现弥散性肌肉痛、肌肉触痛、CPK升高>5倍ULN患者,则应立即停药并给予相应治疗。(Ⅱ级,强烈推荐)
肝损伤和肌肉损伤是导致患者降脂药物“不耐受”,甚至停药的主要原因,但总体的发生率较低[61-62]。前者主要表现为无症状性丙氨酸氨基转移酶(alanine aminotransferase, ALT)和(或)天冬氨酸氨基转移酶(aspartate aminotransferase, AST)轻中度升高。少数可表现为胆汁淤积性肝炎(如总胆红素、碱性磷酸酶升高),肝衰竭极为罕见[63]。用药期间发现肝脏生化异常,需明确其原因,排除非降脂药物(如脂肪肝、胆道疾病、新发病毒性肝炎、酒精性肝病等)和其他合并用药引起的相关指标异常。若为降脂药物引起,依据肝损伤的程度分级,采取不同的处置方法。对于AST和ALT轻度升高(<3倍ULN),可在监测下减量用药并予以护肝治疗。当AST或ALT重度升高(>3倍ULN)时,应停止用药。用药期间患者出现肌肉相关的症状都应考虑药物相关,包括弥散性肌肉痛,肌肉触痛和肌酸磷酸激酶(creatine phosphokinase, CPK)显著升高(>5倍ULN),应立即停药。因肝损伤和肌肉损伤停药后,如确需降脂治疗,可换用肝毒性较小的药物,并从小剂量开始。换药或调整剂量后,需定期复查肝生化指标和血脂情况。
2.8 如何管理HTG-AP康复期患者继发胰腺功能不全? 2.8.1 如何管理HTG-AP康复期患者继发胰腺内分泌功能不全?推荐意见9:HTG-AP康复期患者需定期监测胰腺内分泌功能,对具有肥胖、胰腺炎反复发作、胰腺坏死等PPDM高危因素患者,应采用OGTT等方法进行重点筛查。确诊为PPDM的患者,推荐口服二甲双胍作为一线治疗,必要时可联合其他降糖药物或胰岛素。(Ⅱ级,中等强度推荐)
研究显示,胰腺炎首次发作后6个月内新发糖尿病的累积发生率为3.3%,12个月为7.2%,2年为11.2%,且随着病程延长而逐渐增加[64]。男性、青年、肥胖、胰腺炎反复发作,胰腺外分泌功能障碍、胰腺坏死面积>30%及胰腺包裹性坏死等均是其发病的危险因素[65-68]。值得注意的是,即使胰腺炎仅发作一次,也可能导致胰腺炎后糖尿病(post-pancreatitis diabetes mellitus, PPDM)的发生[69]。HTG-AP患者是否较其他类型胰腺炎患者具有更高的PPDM风险,尚存争议[70]。但已有的研究显示HTG及胰腺内脂肪沉积,是PPDM的危险因素[71-72]。AP患者在急性发作后3~6个月内应进行糖尿病筛查,并在此后每年筛查1次。采用口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)筛查[73],可以实现该疾病高风险人群的早期诊断,降低漏诊率[69]。口服二甲双胍是PPDM的一线治疗方案[74]。如β细胞功能严重受损,口服降糖药物难以控制血糖,需早期启动胰岛素治疗。强化血清TG控制,有助于更好控制血糖[75]。
2.8.2 如何管理HTG-AP康复期患者胰腺外分泌功能不全?推荐意见10:HTG-AP康复期患者需监测营养状态和大便性状,对于营养不良和大便性状异常(如脂肪泻)患者,应通过检测PE-1进行PEI筛查。确诊PEI的患者应尽早启动PERT,同时应加强营养支持、控脂、戒酒及戒烟等综合治疗。(Ⅰ级,强烈推荐)
HTG-AP反复发作,直接损伤腺泡细胞,并通过游离脂肪酸介导的炎症反应加剧胰腺实质坏死[76]。此外,胰管阻塞、腺泡细胞受体功能障碍及胰腺纤维化,可发展为慢性胰腺炎,导致胰腺外分泌功能不全(pancreatic exocrine insufficiency, PEI)[77]。HTG-AP康复期患者需密切观察大便形状(如脂肪泻)及营养状态,定期监测粪弹性蛋白酶1(fecal elastase-1, FE-1)及营养指标(如脂溶性维生素、血清白蛋白)。FE-1测定是诊断PEI的首选无创方法:FE-1<200 μg/g提示PEI,FE-1<100 μg/g提示重度PEI[73, 78]。而13碳-标记混合甘油三酯呼气试验可能是一种较为理想的检测方式,但仍需更多的研究去证实其有效性[79]。若无条件开展FE-1检测,可结合临床症状(如脂肪泻、体重减轻)及试验性胰酶替代治疗(pancreatic enzyme replacement therapy, PERT)4~6周后进行综合评估[80]。PERT是PEI的核心治疗,建议HTG-AP患者开始经口饮食后同步启动。推荐每顿正餐给予40 000~50 000 USP单位胰酶(餐中整粒吞服以保持肠溶包衣完整性),根据症状调整剂量。若疗效不佳,可联合质子泵抑制剂优化十二指肠pH环境[81]。饮食方面,每日脂肪摄入应占总热量30%,避免低脂或高纤维饮食。定期检测脂溶性维生素和骨密度,必要时补充脂溶性维生素D及微量元素[82]。同时,严格控脂(血清TG<5.65 mmol/L),戒酒、戒烟,以降低胰腺炎复发风险及延缓PEI进展[83]。
2.9 如何管理HTG-AP康复期患者的其他合并疾病? 2.9.1 如何管理HTG合并糖尿病?推荐意见11:HTG-AP康复期患者HTG合并糖尿病的管理,需以生活方式干预为基础,结合个体化药物治疗(优先选择二甲双胍、GLP-1RA或SGLT2i)及强化降脂治疗。动态监测血糖和血脂指标,并适时调整方案,实现血糖与血脂双重达标。(Ⅱ级,强烈推荐)
HTG患者常合并糖尿病,血糖控制不佳会进一步升高TG水平,是HTG-AP复发的重要危险因素。有糖尿病史的HTG-AP患者,其复发风险是无糖尿病史患者的2.6倍[14]。生活方式干预是血糖管理的基础,通过合理饮食和适量运动可改善胰岛素敏感性[84-85]。应特别注意避免空腹运动,以防发生低血糖。在药物治疗方面,HTG合并糖尿病的患者宜优先选择兼具调脂或心血管获益的降糖药物,如二甲双胍、胰高血糖素样肽-1受体激动剂(glucagon like peptide-1 receptor agonists, GLP-1RA)、钠-葡萄糖共转运蛋白2抑制剂(sodiumglucose cotransporter 2 inhibitors, SGLT2i)。若口服降糖药效果不佳或患者存在严重高血糖,应及时启动胰岛素治疗[85-87]。此类患者需联合监测血糖和血脂,血糖和TG控制目标建议为:空腹血糖5.6~7.0 mmol/L,餐后2 h血糖 < 10.0 mmol/L,HbA1c < 7.0%,TG<1.7 mmol/L,并可依据患者具体情况进行个体化调整。血糖监测在治疗调整期建议每日4~7次,涵盖空腹、三餐后、睡前及必要时夜间时段;稳定期可降至每周2~4次,需包含空腹及餐后血糖。血脂监测在初始治疗阶段应每4~8周复查一次,包括TG、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇及非高密度脂蛋白胆固醇,以评估疗效;进入稳定期后,可调整为每3~6个月复查1次。
2.9.2 如何管理HTG合并肥胖?推荐意见12:HTG合并肥胖患者的管理应以减重为核心,整合生活方式干预(饮食调整、规律运动、心理干预)、药物治疗或减重手术,个体化设定减重目标,并定期评估减重效果和代谢指标,最终实现持续的体重管理和长期健康改善。(Ⅳ级,中等强度推荐)
对于HTG合并超重(24 kg/m2<BMI<27.9 kg/m2)或肥胖(BMI > 28 kg/m2)的患者,减重是核心治疗目标[88]。推荐借助“一秤一尺一日历”进行日常管理,即定期用体重秤监测体重变化、用腰围尺评估腹部脂肪,并通过日历记录每日饮食、运动及用药,以提高管理依从性和效果。每3~6个月应评估体重、BMI、腰围和血脂等指标,并据此调整治疗方案。超重或轻度肥胖者(28 kg/m2<BMI<32.5 kg/m2),建议3~6个月内减重5%~15%,对于中重度肥胖症患者,可设定更高的减重目标[89-90]。生活方式干预是基础,包括饮食、运动与心理行为管理。建议低脂饮食,每日烹调用油不超过25 g,减少饱和脂肪,增加ω-3多不饱和脂肪酸和膳食纤维摄入;每周规律进行中等强度有氧运动及抗阻训练,避免久坐。可配合认知行为疗法(cognitive behavioral therapy, CBT)改善不良进食行为。若生活方式干预效果不佳,可在此基础上,联合使用GLP-1RA等减重药物[91],甚至考虑减重代谢手术[92]。
2.10 HTG-AP康复期患者该如何进行营养管理? 2.10.1 HTG-AP康复期患者该如何进行营养评估?推荐意见13:HTG-AP康复期患者营养评估需综合人体测量结果、生化指标及饮食摄入情况,采用SGA或NRS-2002工具量化评估,根据评估结果制定个性化的营养干预方案。(Ⅱ级,中等强度推荐)
营养不足或营养过剩在HTG-AP康复期患者均有可能发生,部分患者由于局部并发症,如假性囊肿,包裹性坏死、PEI或进食后疼痛、腹胀等不适等导致摄入不足,从而发生营养不良;部分患者则因自控能力较差,在康复期未能坚持良好的生活习惯,出现饮食过量的问题。因此需对HTG-AP康复期患者开展营养评估,其核心指标包括:体重丢失情况、膳食摄入状况、体质指数、腰围。实验室检测指标包括:血清TG及反映近期营养状况的血清白蛋白、前白蛋白、转铁蛋白、视黄醇结合蛋白、维生素D水平[73, 82, 93]。可采用营养风险筛查2002(nutritional risk screening 2002, NRS-2002)进行营养风险筛查[94]。若NRS-2002评分≥3分,则提示存在营养风险[95]。采用主观全面评估(subjective global assessment, SGA)对营养现状进行评估[93]。
2.10.2 HTG-AP康复期患者应该如何进行营养干预?推荐意见14:对存在营养风险的HTG-AP康复期患者,营养干预应以膳食调整和营养教育为主,效果不佳者,依次升级为口服营养补充剂、管饲肠内营养。(Ⅲ级,中等强度推荐)
对HTG-AP康复期存在营养风险的患者进行营养干预,采取阶梯递进的原则。首先从膳食调整和营养教育入手,通过调整普通饮食的质地、少食多餐、增加营养密度高的食物等方式,努力让患者通过经口进食满足需求。同时,对患者和家属进行营养知识教育。若上述措施效果不佳,在普通饮食的基础上,额外提供口服营养补充剂。当患者完全无法经口进食,或患者3~5 d内经口营养补充不能满足营养目标量的60%,应予以管饲营养。实施管饲时,首选鼻胃管途径。如患者出现不耐受,则应改用鼻空肠喂养[96]。在肠内营养制剂选择方面,推荐优先使用蛋白质水解度高、二或三肽含量高、脂肪含量低的短肽类制剂[97]。其消化和吸收速度更快,且可以更快提升血清白蛋白和前白蛋白水平,降低胃肠道不良反应发生率。
2.10.3 肠道微生态管理在HTG-AP康复期有什么作用?推荐意见15:HTG-AP康复期患者在肠道功能初步恢复、可耐受肠内营养后尽早开始微生态干预,补充益生菌和益生元,并根据个体化情况调整剂量。(Ⅰ级,中等强度推荐)
HTG-AP患者往往存在肠道菌群失调,失衡的肠道菌群可导致肠道菌群移位,引起胰腺坏死感染或胰腺假性囊肿继发感染[98],并可通过促进内毒素吸收或干扰胆汁酸代谢等途径加剧HTG[99]。微生态干预可修复肠道屏障功能,减少内毒素易位入血,减少胰腺坏死感染的发生[100]。补充益生菌和益生元可优化菌群结构,促进短链脂肪酸生成,间接降低血清TG水平[101-102]。肠道菌群参与蛋白质、维生素等营养素的合成与吸收,改善微生态有助于改善康复期患者的营养状态。在康复期管理中,建议在患者肠道功能初步恢复、可耐受肠内营养后尽早开始微生态干预。益生菌推荐使用含长双歧杆菌、嗜酸乳杆菌、粪肠球菌等的复合制剂,益生元可选用低聚果糖、菊粉、膳食纤维等,可混入肠内营养制剂或口服补充[103]。应注意益生菌与抗菌药物服用间隔至少2 h,以避免活性受抑制[104]。结合临床监测菌群变化及血脂、营养指标,个体化调整剂量,进一步提升康复效果。
2.11 HTG-AP康复期患者的心理评估和干预方法有哪些?推荐意见16:反复发作的HTG-AP康复期患者易继发焦虑、抑郁等心理问题,应对该类患者进行心理评估与干预,并遵循“早期筛查、精准干预、全程跟踪”的原则。推荐使用SCL-90、SDS/SAS作为核心评估工具,结合CBT、放松训练及家庭支持等方法进行干预,必要时辅以药物治疗。(Ⅲ级,弱推荐)
HTG-AP康复期心理管理应贯穿诊疗全程。通过多维度评估工具筛查焦虑、抑郁及创伤后应激障碍(post-traumatic stress disorder, PTSD)风险[105]。心理评估核心工具包括症状自评量表(symptom checklist-90, SCL-90)全面筛查心理症状,抑郁/焦虑自评量表(Self-Rating Depression Scale, SDS/Self-Rating Anxiety Scale, SAS)快速识别情绪障碍,创伤后应激障碍检查表(PTSD Checklist for DSM-5, PCL-5)针对重症患者进行专项评估,匹兹堡睡眠质量指数(Pittsburgh sleep quality index, PSQI)评估睡眠质量,动态监测每2周1次以量化心理状态变化。心理干预以认知行为疗法为基础,结合应激管理训练(正念冥想、生物反馈)、社会支持强化及药物抗抑郁治疗,纠正负性思维、建立健康行为模式,改善患者认知[106]。通过定期量表评分及生活质量评估(short form-36 health survey, SF-36)监测干预效果[73],持续优化管理方案。
2.12 如何应用中医方法促进HTG-AP患者康复并减少复发?推荐意见17:在HTG-AP康复期,可结合中医辨证论治,以活血化瘀、健脾益气等为主,同时运用针灸推拿及中国传统锻炼功法等多种手段,促进HTG-AP患者康复、减少复发并改善生活质量。(Ⅲ级, 弱推荐)
中医在HTG-AP康复期可通过多靶点作用,降低复发风险并改善相关症状。中药治疗以辨证论治为核心,根据证型选用大黄汤、茵陈蒿汤、大柴胡汤等方剂。配伍绞股蓝、决明子等具有降脂作用的中药及黄芩、大黄等调节代谢通路的药物,协同降低TG水平[107]。应用针灸推拿刺激足三里、阳陵泉等穴位,调节神经-内分泌-免疫网络,缓解腹痛、腹胀,并促进胃肠功能恢复。耳穴压豆疗法可有助于改善患者焦虑状态。传统锻炼功法如太极拳、八段锦、心身桩等通过调节代谢与心理状态发挥协同作用,有助于改善患者整体认知功能,提升患者的心理幸福感,缓解焦虑、抑郁等心理状况[108-109]。
2.13 如何对HTG-AP康复期患者进行生存质量评估?推荐意见18:HTG-AP康复期患者,特别是存在复杂并发症、代谢控制不佳、反复复发或伴有焦虑、抑郁状态者应进行生存质量评估,内容涵盖生理代谢功能、营养状态、社会心理及行为管理等多个维度。(Ⅱ级,中等强度推荐)
HTG-AP康复期患者因代谢紊乱、胰腺功能受损、饮食限制及心理社会适应等问题,常出现生理、心理及社会功能的多方面影响。因此,应在康复阶段对患者实施多维度生活质量评估,以全面了解疾病对其整体健康的影响,并为个体化康复管理提供依据。具体评估内容包括:(1)生理代谢功能:每月记录腹痛、腹胀和脂肪泻频率[15];定期检测血清TG,每3~6个月检查肝生化指标、HbA1c和胰腺外分泌功能。(2)营养状态:每6个月评估BMI、血清白蛋白和维生素D水平[90]。(3)社会心理:每6个月用医院焦虑抑郁量表(hospital anxiety and depression scale, HADS)或患者健康问卷-9项(patient health questionnaire-9, PHQ-9)进行筛查,如HADS≥8或PHQ-9≥10时,应转诊心理科进行专业评估与干预[110]。(4)行为管理:采用24 h膳食回顾法评估脂肪摄入量,使用食物频率问卷(food frequency questionnaire, FFQ)评估饮食依从性[111]。推荐使用国际体力活动问卷(international physical activity questionnaire, IPAQ)评估每周中等强度运动是否≥150 min[112]。
2.14 HTG-AP康复期患者如何开展门诊随访与监测?推荐意见19:HTG-AP康复期患者门诊随访应包括血脂监测、药物治疗与安全性监测、并发症监测及合并症管理和健康宣教等内容。首次随访时间为出院后2~4周,之后分别于出院后第3、6、12个月进行随访,高危人群每3~6个月随访1次,病情稳定后每年随访1次。(Ⅳ级,中等强度推荐)
HTG-AP康复期患者随访内容应涵盖以下几个方面。(1)健康宣教:通过个体化教育强化患者对危险因素(如高脂饮食、酗酒、肥胖)的认知,指导健康的生活方式。教育患者识别急性发作预警症状(如持续性腹痛、频繁呕吐)。同时应强调家属培训与支持,指导其掌握低脂饮食制备方法、心理支持技巧及紧急情况处理措施。(2)血脂监测:首次随访于出院后2~4周内完成空腹血脂检测,达标者每3~6个月复查;未达标者,需4~6周复查并根据结果调整治疗方案[113]。(3)药物治疗与安全性监测:强调规范使用降脂药物,指导患者识别常见药物不良反应(如肌痛、肝酶异常)并及时反馈。(4)并发症监测:每3~6个月评估血糖、腹部影像学,筛查糖尿病、胰腺假性囊肿,包裹性坏死等并发症,根据复查结果调整复查周期[114]。(5)合并症管理:针对患者存在的合并症,应制定并实施相应的管理计划,进行规范治疗和监测。HTG-AP康复期患者管理流程见图 1。
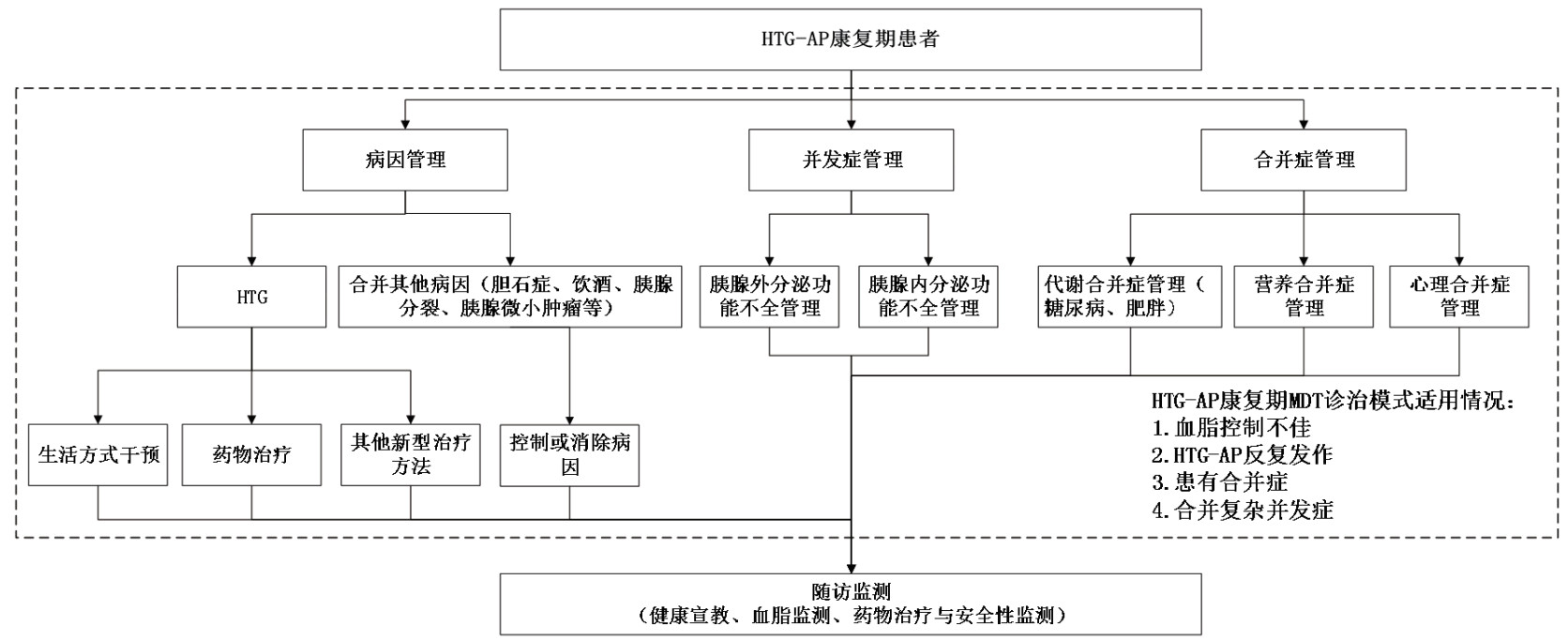
|
| 图 1 HTG-AP康复期患者管理流程图 |
|
|
推荐意见20:针对HTG-AP反复复发、TG控制不佳,具有合并症和复杂并发症的HTG-AP康复期患者,建议开展MDT诊疗,为患者提供并发症与合并症防治、药物治疗、营养评估与干预、生活方式干预、肠道微生态管理、中医中药治疗、心理评估与干预等AP防治一体化的整合服务。(Ⅳ级,中等强度推荐)
通过MDT模式,不同学科的专家可以在团队会议中分享各自的专业意见,共同制定综合的治疗方案,避免治疗的矛盾和重复,同时减少患者在不同科室间奔波,提高医疗资源的利用效率,提高患者的依从性和满意度。多学科团队(medical decision team, MDT)[115-116]治疗模式适合人群包括康复期TG控制不佳,血清TG≥5.6 mmol/L或有复发史者;合并糖尿病、心血管疾病等代谢性疾病的病情复杂患者,急性胰腺炎发作后遗留复杂并发症处理困难的患者。MDT由急诊科、消化科、普通外科、中医科、营养科、内分泌科、心理科、影像科、超声科等多学科医生共同参与。采用线下患者面对面的方式或线上会议形式,为患者提检查结果解读,生活方式调整、营养、药物治疗、合并症防治、决定随访方案等内容的健康服务。
3 结语本共识梳理了HTG-AP康复期的常见问题,构建了多学科协作管理的框架,旨在通过规范化管理降低HTG-AP患者并发症发生率和复发风险,提升康复期生活质量。然而,本共识仍存在一定的局限性,部分推荐意见的循证医学证据级别不高,亟需未来高质量随机对照试验进一步验证。此外,由于不同层级医疗机构在胰腺炎收治模式、技术可及性方面存在差异,可能影响共识的落地应用。随着循证医学证据的不断积累和临床实践的深入,尤其是在人工智能应用于康复期患者生活方式管理、远程监测与预警、肠道微生态调控及复发预防等领域,高质量随机对照研究不断涌现;同时,针对HTG的新型药物和治疗策略也逐步成熟。在此背景下,本共识将持续更新与修订,以期更精准地契合临床需求,持续优化HTG-AP患者的长期治疗结局与健康状况。
经费来源 共识制定过程中获得浙江省2025年度“尖兵领雁+X”科技计划(2025C02180),2022年浙江省卫生高层次人才培养项目经费支持,经费仅用于专家咨询费和共识全文出版费。经费对推荐意见的形成不存在影响
执笔:许利明金森军周晟昂郎笑梅[浙江省人民医院(杭州医学院附属人民医院)]
共识专家组成员(按姓名拼音排序):蔡文伟[浙江省人民医院(杭州医学院附属人民医院)] 邓力珲(四川大学华西医院)郭丰(浙江大学医学院附属邵逸夫医院)郭树彬(首都医科大学附属北京朝阳医院)何文华(南昌大学第一附属医院)何小军(浙江大学医学院附属第二医院)胡国勇(上海交通大学附属第一人民医院)胡良皞(海军军医大学第一附属医院)黄耿文(中南大学湘雅医院)柯路(东部战区总医院)李非(首都医科大学宣武医院)李惠萍(温州医科大学附属第一医院)李茜[浙江省人民医院(杭州医学院附属人民医院)] 李维勤(东部战区总医院)蔺际龑(厦门大学附属第一医院)廖峥娈[浙江省人民医院(杭州医学院附属人民医院)] 路国涛(扬州大学附属医院)马岳峰(浙江大学医学院附属第二医院)毛恩强(上海交通大学医学院附属瑞金医院)梅雪(首都医科大学附属北京朝阳医院)尚东(大连医科大学附属第一医院)石乔(武汉大学人民医院)宋振举(复旦大学附属中山医院)孙备(哈尔滨医科大学附属第一医院)孙昀(安徽医科大学第二附属医院)涂建锋[浙江省人民医院(杭州医学院附属人民医院)] 童智慧(东部战区总医院)文礼(北京协和医院)王刚(哈尔滨医科大学附属第一医院)武晓泓[浙江省人民医院(杭州医学院附属人民医院)] 徐峰(山东大学齐鲁医院)虞洪(浙江大学医学院附属邵逸夫医院)虞文魁(南京大学医学院附属鼓楼医院)张国强(中日友好医院)张茂(浙江大学医学院附属第二医院)张匀(浙江大学医学院附属第一医院)邹文斌(海军军医大学第一附属医院)赵晓东(中国人民解放军总医院)郑悦亮(浙江省人民医院(杭州医学院附属人民医院)朱长举(郑州大学第一附属医院)朱华栋(北京协和医院)
利益冲突 所有作者声明无利益冲突
| [1] | Mederos MA, Reber HA, Girgis MD. Acute pancreatitis[J]. JAMA, 2021, 325(4): 382. DOI:10.1001/jama.2020.20317 |
| [2] | Yu BJ, Li JR, Li NS, et al. Progression to recurrent acute pancreatitis after a first attack of acute pancreatitis in adults[J]. Pancreatology, 2020, 20(7): 1340-1346. DOI:10.1016/j.pan.2020.09.006 |
| [3] | Lu JD, Wang Z, Mei WT, et al. A systematic review of the epidemiology and risk factors for severity and recurrence of hypertriglyceridemia-induced acute pancreatitis[J]. BMC Gastroenterol, 2025, 25(1): 374. DOI:10.1186/s12876-025-03954-4 |
| [4] | Coté GA, Yadav D, Abberbock JA, et al. Recurrent acute pancreatitis significantly reduces quality of life even in the absence of overt chronic pancreatitis[J]. Am J Gastroenterol, 2018, 113(6): 906-912. DOI:10.1038/s41395-018-0087-7 |
| [5] | 曹龙祥, 吕铖, 徐怡禛, 等. 中国高三酰甘油血症性急性胰腺炎发病比例变化趋势的荟萃分析[J]. 中华胰腺病杂志, 2025, 25(1): 24-31. DOI:10.3760/cma.j.cn115667-20241104-00186 |
| [6] | Zhu Y, Pan XL, Zeng H, et al. A study on the etiology, severity, and mortality of 3260 patients with acute pancreatitis according to the revised Atlanta classification in Jiangxi, China over an 8-year period[J]. Pancreas, 2017, 46(4): 504-509. DOI:10.1097/MPA.0000000000000776 |
| [7] | Bai Y, Jia L, Wang BS, et al. Acute pancreatitis in the Guangdong Province, China[J]. Digestion, 2007, 75(2/3): 74-79. DOI:10.1159/000102959 |
| [8] | Yin GJ, Cang XF, Yu G, et al. Different clinical presentations of hyperlipidemic acute pancreatitis: a retrospective study[J]. Pancreas, 2015, 44(7): 1105-1110. DOI:10.1097/MPA.0000000000000403 |
| [9] | 李帅, 周晶, 罗贵贤, 等. 首发和复发急性高甘油三酯血症胰腺炎临床特征比较的全国多中心临床研究[J]. 中华消化外科杂志, 2024, 23(5): 703-711. DOI:10.3760/cma.j.cn115610-20240308-00146 |
| [10] | 何文华, 祝荫, 朱勇, 等. 高甘油三酯血症与其他病因所致急性胰腺炎的病情严重程度及预后比较[J]. 中华医学杂志, 2016, 96(32): 2569-2572. DOI:10.3760/cma.j.issn.0376-2491.2016.32.011 |
| [11] | Sofi F, Dinu M, Pagliai G, et al. Mediterranean versus vegetarian diet for cardiovascular disease prevention (the CARDIVEG study): study protocol for a randomized controlled trial[J]. Trials, 2016, 17(1): 233. DOI:10.1186/s13063-016-1353-x |
| [12] | Ding L, Li S, Cao LX, et al. Recurrence of hypertriglyceridemia-associated acute pancreatitis: a multicenter, prospective cohort study[J]. Eur J Intern Med, 2024, 125: 98-103. DOI:10.1016/j.ejim.2024.03.022 |
| [13] | Fan ZY, Zhang YL, Li JN, et al. Global burden and characterization of hypertriglyceridemia-induced acute pancreatitis: results from a systematic review and a multi-center cohort study[J]. Sci China Life Sci, 2025. DOI:10.1007/s11427-024-2900-6 |
| [14] | Ding L, Guan LY, Li XY, et al. Recurrence for patients with first episode of hypertriglyceridemia-induced acute pancreatitis: a prospective cohort study[J]. J Clin Lipidol, 2023, 17(1): 94-102. DOI:10.1016/j.jacl.2022.11.006 |
| [15] | Valdivielso P, Ramírez-Bueno A, Ewald N. Current knowledge of hypertriglyceridemic pancreatitis[J]. Eur J Intern Med, 2014, 25(8): 689-694. DOI:10.1016/j.ejim.2014.08.008 |
| [16] | Xiang JX, Hu LS, Liu P, et al. Impact of cigarette smoking on recurrence of hyperlipidemic acute pancreatitis[J]. World J Gastroenterol, 2017, 23(47): 8387-8394. DOI:10.3748/wjg.v23.i47.8387 |
| [17] | Carr RA, Rejowski BJ, Cote GA, et al. Systematic review of hypertriglyceridemia-induced acute pancreatitis: a more virulent etiology?[J]. Pancreatology, 2016, 16(4): 469-476. DOI:10.1016/j.pan.2016.02.011 |
| [18] | Zafrir B, Saliba W, Jubran A, et al. Severe hypertriglyceridemia-related pancreatitis: characteristics and predictors of recurrence[J]. Pancreas, 2019, 48(2): 182-186. DOI:10.1097/MPA.0000000000001235 |
| [19] | Fredrickson DS. An international classification of hyperlipidemias and hyperlipoproteinemias[J]. Ann Intern Med, 1971, 75(3): 471-472. DOI:10.7326/0003-4819-75-3-471 |
| [20] | Mundal LJ, Igland J, Svendsen K, et al. Association of familial hypercholesterolemia and statin use with risk of dementia in Norway[J]. JAMA Netw Open, 2022, 5(4): e227715. DOI:10.1001/jamanetworkopen.2022.7715 |
| [21] | Ginsberg HN, Goldberg IJ. Broadening the scope of dyslipidemia therapy by targeting APOC3 (apolipoprotein C3) and ANGPTL3 (angiopoietin-like protein 3)[J]. Arterioscler Thromb Vasc Biol, 2023, 43(3): 388-398. DOI:10.1161/ATVBAHA.122.317966 |
| [22] | Simha V. Management of hypertriglyceridemia[J]. BMJ, 2020, 371: m3109. DOI:10.1136/bmj.m3109 |
| [23] | Moreta Rodríguez M, Peñas Herrero I, Cubero Morais P, et al. Acute pancreatitis secondary to severe hypertriglyceridemia induced by antiretroviral therapy[J]. Rev Esp Enferm Dig, 2024, 116(10): 578-579. DOI:10.17235/reed.2024.10423/2024 |
| [24] | Hang Y, Chen Y, Lu LX, et al. Acute hyperlipidemic pancreatitis in a pregnant woman[J]. World J Emerg Med, 2013, 4(4): 311-313. DOI:10.5847/wjem.j.issn.1920-8642.2013.04.013 |
| [25] | 梅莉芬, 甘泉, 胡晶, 等. 妊娠期高甘油三酯血症性急性胰腺炎的临床特征及重症进展的预测因素分析[J]. 中国普通外科杂志, 2024, 33(3): 393-399. DOI:10.7659/j.issn.1005-6947.2024.03.010 |
| [26] | 毛恩强, 李兆申. 急性胰腺炎病因诊断与分类的再认识[J]. 中华胰腺病杂志, 2019, 19(6): 401-403. DOI:10.3760/cma.j.issn.1674-1935.2019.06.001 |
| [27] | Strand DS, Law RJ, Yang D, et al. AGA clinical practice update on the endoscopic approach to recurrent acute and chronic pancreatitis: expert review[J]. Gastroenterology, 2022, 163(4): 1107-1114. DOI:10.1053/j.gastro.2022.07.079 |
| [28] | 秦巧, 陈姝谕, 李姣, 等. 超声内镜对急性胰腺炎病因诊断的临床价值[J]. 中华胰腺病杂志, 2025, 5(2): 139-142. DOI:10.3760/cma.j.cn115667-20240611-00105 |
| [29] | 季钧淘, 张菂, 辛磊, 等. 复发性急性胰腺炎诊断与治疗研究进展[J]. 中华胰腺病杂志, 2016, 16(3): 203-205. DOI:10.3760/cma.j.issn.1674-1935.2016.03.016 |
| [30] | 许利明, 涂建锋. 复发性高甘油三酯血症性急性胰腺炎康复期复发防治难点与策略[J]. 中华急诊医学杂志, 2024, 33(10): 1349-1353. DOI:10.3760/cma.j.issn.1671-0282.2024.10.001 |
| [31] | Meeralam Y, Al-Shammari K, Yaghoobi M. Diagnostic accuracy of EUS compared with MRCP in detecting choledocholithiasis: a meta-analysis of diagnostic test accuracy in head-to-head studies[J]. Gastrointest Endosc, 2017, 86(6): 986-993. DOI:10.1016/j.gie.2017.06.009 |
| [32] | Somani P, Sunkara T, Sharma M. Role of endoscopic ultrasound in idiopathic pancreatitis[J]. World J Gastroenterol, 2017, 23(38): 6952-6961. DOI:10.3748/wjg.v23.i38.6952 |
| [33] | Ishii Y, Serikawa M, Tsuboi T, et al. Role of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography in the diagnosis of pancreatic cancer[J]. Diagnostics (Basel), 2021, 11(2): 238. DOI:10.3390/diagnostics11020238 |
| [34] | Fischer M, Hassan A, Sipe BW, et al. Endoscopic retrograde cholangiopancreatography and manometry findings in 1, 241 idiopathic pancreatitis patients[J]. Pancreatology, 2010, 10(4): 444-452. DOI:10.1159/000264675 |
| [35] | Suzuki M, Minowa K, Nakano S, et al. Genetic abnormalities in pancreatitis: an update on diagnosis, clinical features, and treatment[J]. Diagnostics (Basel), 2020, 11(1): 31. DOI:10.3390/diagnostics11010031 |
| [36] | Hansen SEJ, Madsen CM, Varbo A, et al. Genetic variants associated with increased plasma levels of triglycerides, via effects on the lipoprotein lipase pathway, increase risk of acute pancreatitis[J]. Clin Gastroenterol Hepatol, 2021, 19(8): 1652-1660.e6. DOI:10.1016/j.cgh.2020.08.016 |
| [37] | 李梦雨, 魏伟, 王敏. 脂代谢基因多态性在高脂血症型急性胰腺炎发病机制与个体化治疗中的研究进展[J]. 中国普通外科杂志, 2025, 34(7): 1542-1552. DOI:10.7659/j.issn.1005-6947.250325 |
| [38] | Greer JB, Thrower E, Yadav D. Epidemiologic and mechanistic associations between smoking and pancreatitis[J]. Curr Treat Options Gastroenterol, 2015, 13(3): 332-346. DOI:10.1007/s11938-015-0056-9 |
| [39] | 黄晓东, 黄贤伟, 杨成彬, 等. 复发性高脂血症性急性胰腺炎列线图预测模型[J]. 中华急诊医学杂志, 2023, 32(10): 1346-1349. DOI:10.3760/cma.j.issn.1671-0282.2023.10.009 |
| [40] | Fantino M, Paquette M, Blais C, et al. Both low-fat and low-carbohydrate diets reduce triglyceride concentration in subjects with multifactorial chylomicronemia syndrome: a randomized crossover study[J]. Nutr Res, 2022, 101: 43-52. DOI:10.1016/j.nutres.2022.02.001 |
| [41] | Virani SS, Morris PB, Agarwala A, et al. 2021 ACC expert consensus decision pathway on the management of ASCVD risk reduction in patients with persistent hypertriglyceridemia A report of the American college of cardiology solution set oversight committee[J]. J Am Coll Cardiol, 2021, 78(9): 960-993. DOI:10.1016/j.jacc.2021.06.011 |
| [42] | Byrne A, Makadia S, Sutherland A, et al. Optimizing non-pharmacologic management of hypertriglyceridemia[J]. Arch Med Res, 2017, 48(6): 483-487. DOI:10.1016/j.arcmed.2017.11.017 |
| [43] | 中国医师协会内分泌代谢科医师分会, 国家心血管病专家委员会心血管代谢医学专业委员会. 糖尿病患者血脂管理中国专家共识(2024版)[J]. 中华糖尿病杂志, 2024, 16(4): 383-403. DOI:10.3969/j.issn.1000-3614.2024.04.002 |
| [44] | Agher D, Sedki K, Despres S, et al. Encouraging behavior changes and preventing cardiovascular diseases using the prevent connect mobile health app: conception and evaluation of app quality[J]. J Med Internet Res, 2022, 24(1): e25384. DOI:10.2196/25384 |
| [45] | Fernandez-Lazaro CI, Santamaría G, Fernandez Milano A, et al. Nutrition-related mobile apps in the Spanish app stores: quality and content analysis[J]. JMIR Mhealth Uhealth, 2024, 12: e52424. DOI:10.2196/52424 |
| [46] | Das Pradhan A, Glynn RJ, Fruchart JC, et al. Triglyceride lowering with pemafibrate to reduce cardiovascular risk[J]. N Engl J Med, 2022, 387(21): 1923-1934. DOI:10.1056/NEJMoa2210645 |
| [47] | Study Group ACCODD, Ginsberg HN, Elam MB, et al. Effects of combination lipid therapy in type 2 diabetes mellitus[J]. N Engl J Med, 2010, 362(17): 1563-1574. DOI:10.1056/NEJMoa1001282 |
| [48] | Skulas-Ray AC, Wilson PWF, Harris WS, et al. Omega-3 fatty acids for the management of hypertriglyceridemia: a science advisory from the American heart association[J]. Circulation, 2019, 140(12): e673-e691. DOI:10.1161/CIR.0000000000000709 |
| [49] | Zhao SP, Liu L, Cheng YC, et al. Effect of Xuezhikang, a cholestin extract, on reflecting postprandial triglyceridemia after a high-fat meal in patients with coronary heart disease[J]. Atherosclerosis, 2003, 168(2): 375-380. DOI:10.1016/s0021-9150(03)00142-4 |
| [50] | Feingold K R. Triglyceride Lowering Drugs[M]//Feingold KR, AHMED S F, ANAWALT B, et al. Endotext. South Dartmouth (MA); MDText. com, Inc. Copyright © 2000-2025, MDText. com, Inc. 2000. |
| [51] | Gouni-Berthold I, Alexander VJ, Yang QQ, et al. Efficacy and safety of volanesorsen in patients with multifactorial chylomicronaemia (COMPASS): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial[J]. Lancet Diabetes Endocrinol, 2021, 9(5): 264-275. DOI:10.1016/S2213-8587(21)00046-2 |
| [52] | Watts GF, Rosenson RS, Hegele RA, et al. Plozasiran for managing persistent chylomicronemia and pancreatitis risk[J]. N Engl J Med, 2025, 392(2): 127-137. DOI:10.1056/NEJMoa2409368 |
| [53] | Rangwala HS, Fatima H, Ali M, et al. Evaluating the effectiveness and safety of evinacumab in treating hypercholesterolemia and hypertriglyceridemia: a systematic review and meta-analysis of randomized controlled trials[J]. Am J Cardiovasc Drugs, 2024, 24(4): 523-535. DOI:10.1007/s40256-024-00649-1 |
| [54] | Gaudet D, Méthot J, Déry S, et al. Efficacy and long-term safety of alipogene tiparvovec (AAV1-LPLS447X) gene therapy for lipoprotein lipase deficiency: an open-label trial[J]. Gene Ther, 2013, 20(4): 361-369. DOI:10.1038/gt.2012.43 |
| [55] | Miller M, Stone NJ, Ballantyne C, et al. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association[J]. Circulation, 2011, 123(20): 2292-2333. DOI:10.1161/CIR.0b013e3182160726 |
| [56] | Jacobson TA, Ito MK, Maki KC, et al. National lipid association recommendations for patient-centered management of dyslipidemia: part 1: full report[J]. J Clin Lipidol, 2015, 9(2): 129-169. DOI:10.1016/j.jacl.2015.02.003 |
| [57] | 中国血脂管理指南修订联合专家委员会. 中国血脂管理指南(基层版2024年)[J]. 中华心血管病杂志, 2024, 52(4): 330-337. DOI:10.3760/cma.j.cn112148-20240102-00002 |
| [58] | Wu BU, Batech M, Dong EY, et al. Influence of ambulatory triglyceride levels on risk of recurrence in patients with hypertriglyceridemic pancreatitis[J]. Dig Dis Sci, 2019, 64(3): 890-897. DOI:10.1007/s10620-018-5226-x |
| [59] | Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias[J]. Eur Heart J, 2016, 37(39): 2999-3058. DOI:10.1093/eurheartj/ehw272 |
| [60] | Lee MAB, Ng M, Yugendra P, et al. Hemorrhagic pancreatitis from fenofibrate and metformin toxicity: a case report[J]. World J Emerg Med, 2023, 14(6): 495-498. DOI:10.5847/wjem.j.1920-8642.2023.106 |
| [61] | Keech A, Simes RJ, Barter P, et al. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial[J]. Lancet, 2005, 366(9500): 1849-1861. DOI:10.1016/S0140-6736(05)67667-2 |
| [62] | Graham DJ, Staffa JA, Shatin D, et al. Incidence of hospitalized rhabdomyolysis in patients treated with lipid-lowering drugs[J]. JAMA, 2004, 292(21): 2585-2590. DOI:10.1001/jama.292.21.2585 |
| [63] | 中国医药生物技术协会药物性肝损伤防治技术专业委员会, 中华医学会肝病学分会药物性肝病学组. 中国药物性肝损伤诊治指南(2023年版)[J]. 胃肠病学, 2022, 27(6): 341-375. DOI:10.3760/cma.j.cn501113-20230419-00176 |
| [64] | Bharmal SH, Cho J, Alarcon Ramos GC, et al. Trajectories of glycaemia following acute pancreatitis: a prospective longitudinal cohort study with 24 months follow-up[J]. J Gastroenterol, 2020, 55(8): 775-788. DOI:10.1007/s00535-020-01682-y |
| [65] | Pendharkar SA, Mathew J, Petrov MS. Age- and sex-specific prevalence of diabetes associated with diseases of the exocrine pancreas: a population-based study[J]. Dig Liver Dis, 2017, 49(5): 540-544. DOI:10.1016/j.dld.2016.12.010 |
| [66] | Ho TW, Wu JM, Kuo TC, et al. Change of both endocrine and exocrine insufficiencies after acute pancreatitis in non-diabetic patients: a nationwide population-based study[J]. Medicine (Baltimore), 2015, 94(27): e1123. DOI:10.1097/MD.0000000000001123 |
| [67] | Cho J, Scragg R, Pandol SJ, et al. Exocrine pancreatic dysfunction increases the risk of new-onset diabetes mellitus: results of a nationwide cohort study[J]. Clin Transl Sci, 2021, 14(1): 170-178. DOI:10.1111/cts.12837 |
| [68] | Tu JF, Zhang JZ, Ke L, et al. Endocrine and exocrine pancreatic insufficiency after acute pancreatitis: long-term follow-up study[J]. BMC Gastroenterol, 2017, 17(1): 114. DOI:10.1186/s12876-017-0663-0 |
| [69] | American Diabetes Association Professional Practice Committee. 2. diagnosis and classification of diabetes: standards of care in diabetes-2024[J]. Diabetes Care, 2024, 47(Suppl 1): S20-S42. DOI:10.2337/dc24-S002 |
| [70] | Vujasinovic M, Tepes B, Makuc J, et al. Pancreatic exocrine insufficiency, diabetes mellitus and serum nutritional markers after acute pancreatitis[J]. World J Gastroenterol, 2014, 20(48): 18432-18438. DOI:10.3748/wjg.v20.i48.18432 |
| [71] | Ma JH, Yuan YJ, Lin SH, et al. Nomogram for predicting diabetes mellitus after the first attack of acute pancreatitis[J]. Eur J Gastroenterol Hepatol, 2019, 31(3): 323-328. DOI:10.1097/MEG.0000000000001307 |
| [72] | Singh RG, Cervantes A, Kim JU, et al. Intrapancreatic fat deposition and visceral fat volume are associated with the presence of diabetes after acute pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2019, 316(6): G806-G815. DOI:10.1152/ajpgi.00385.2018 |
| [73] | Tu JF, Zhang JZ, Yang Y, et al. Comparison of pancreatic function and quality of life between patients with infected pancreatitis necrosis undergoing open necrosectomy and minimally invasive drainage: a long-term study[J]. Exp Ther Med, 2020, 20(5): 75. DOI:10.3892/etm.2020.9203 |
| [74] | Cho J, Scragg R, Pandol SJ, et al. Antidiabetic medications and mortality risk in individuals with pancreatic cancer-related diabetes and postpancreatitis diabetes: a nationwide cohort study[J]. Diabetes Care, 2019, 42(9): 1675-1683. DOI:10.2337/dc19-0145 |
| [75] | Singh RG, Nguyen NN, DeSouza SV, et al. Comprehensive analysis of body composition and insulin traits associated with intra-pancreatic fat deposition in healthy individuals and people with new-onset prediabetes/diabetes after acute pancreatitis[J]. Diabetes Obes Metab, 2019, 21(2): 417-423. DOI:10.1111/dom.13523 |
| [76] | 饶靓雯, 周振刚, 赖添明, 等. 急性胰腺炎合并外分泌功能不全的诊治[J]. 中华消化杂志, 2023, 43(2): 137-140. DOI:10.3760/cma.j.cn311367-20220617-00293 |
| [77] | Enrique Dominguez-Muñoz J. Diagnosis and treatment of pancreatic exocrine insufficiency[J]. Curr Opin Gastroenterol, 2018, 34(5): 349-354. DOI:10.1097/MOG.0000000000000459 |
| [78] | Vanga RR, Tansel A, Sidiq S, et al. Diagnostic performance of measurement of fecal elastase-1 in detection of exocrine pancreatic insufficiency: systematic review and meta-analysis[J]. Clin Gastroenterol Hepatol, 2018, 16(8): 1220-1228. DOI:10.1016/j.cgh.2018.01.027 |
| [79] | Powell-Brett S, Hall L, Edwards M, et al. A systematic review and meta-analysis of the accuracy and methodology of the 13C mixed triglyceride breath test for the evaluation of pancreatic function[J]. Pancreatology, 2023, 23(3): 283-293. DOI:10.1016/j.pan.2023.02.004 |
| [80] | Huang W, de la Iglesia-García D, Baston-Rey I, et al. Exocrine pancreatic insufficiency following acute pancreatitis: systematic review and meta-analysis[J]. Dig Dis Sci, 2019, 64(7): 1985-2005. DOI:10.1007/s10620-019-05568-9 |
| [81] | Layer P, Kashirskaya N, Gubergrits N. Contribution of pancreatic enzyme replacement therapy to survival and quality of life in patients with pancreatic exocrine insufficiency[J]. World J Gastroenterol, 2019, 25(20): 2430-2441. DOI:10.3748/wjg.v25.i20.2430 |
| [82] | Working Party of the Australasian Pancreatic Club, Smith RC, Smith SF, et al. Summary and recommendations from the Australasian guidelines for the management of pancreatic exocrine insufficiency[J]. Pancreatology, 2016, 16(2): 164-180. DOI:10.1016/j.pan.2015.12.006 |
| [83] | Tenner S, Vege SS, Sheth SG, et al. American college of gastroenterology guidelines: management of acute pancreatitis[J]. Am J Gastroenterol, 2024, 119(3): 419-437. DOI:10.14309/ajg.0000000000002645 |
| [84] | Su WY, Tao MY, Ma L, et al. Dose-response relationships of resistance training in Type 2 diabetes mellitus: a meta-analysis of randomized controlled trials[J]. Front Endocrinol (Lausanne), 2023, 14: 1224161. DOI:10.3389/fendo.2023.1224161 |
| [85] | 中华医学会糖尿病学分会. 中国糖尿病防治指南[J]. 中华糖尿病杂志, 2025, 17(1): 16-139. DOI:10.3760/cma.j.cn115791-20241203-00705 |
| [86] | Preiss D, Seshasai SRK, Welsh P, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis[J]. JAMA, 2011, 305(24): 2556-2564. DOI:10.1001/jama.2011.860 |
| [87] | Zafrir B, Jain M. Lipid-lowering therapies, glucose control and incident diabetes: evidence, mechanisms and clinical implications[J]. Cardiovasc Drugs Ther, 2014, 28(4): 361-377. DOI:10.1007/s10557-014-6534-9 |
| [88] | Consultation WE. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies[J]. Lancet, 2004, 363(9403): 157-163. DOI:10.1016/S0140-6736(03)15268-3 |
| [89] | Garvey WT, Mechanick JI, Brett EM, et al. American association of clinical endocrinologists and American college of endocrinology comprehensive clinical practice guidelines for medical care of patients with obesity[J]. Endocr Pract, 2016, 22: 1-203. DOI:10.4158/ep161365.gl |
| [90] | 中华人民共和国国家卫生健康委员会医政司. 肥胖症诊疗指南(2024年版)[J]. 中华消化外科杂志, 2024, 23(10): 1237-1260. DOI:10.3760/cma.j.cn115610-20241017-00455 |
| [91] | Davies M, Færch L, Jeppesen OK, et al. Semaglutide 2·4 Mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial[J]. Lancet, 2021, 397(10278): 971-984. DOI:10.1016/S0140-6736(21)00213-0 |
| [92] | Ghiassi S, Nimeri A, Aleassa EM, et al. American Society for Metabolic and Bariatric Surgery position statement on one-anastomosis gastric bypass[J]. Surg Obes Relat Dis, 2024, 20(4): 319-335. DOI:10.1016/j.soard.2023.11.003 |
| [93] | 丁丽丽, 朱明炜, 孙殿水, 等. 应用前白蛋白检测营养风险筛查2002, 主观全面评定和微小营养评定的灵敏度和特异度: 探索性, 前瞻性, 多中心临床研究[J]. 中华临床营养杂志, 2011, 19(6): 360-363. DOI:10.3760/cma.j.issn.1674-635X.2011.06.002 |
| [94] | 朱国英, 黄东平, 黄建伟, 等. 慢性胰腺炎病人营养风险筛查和危险因素分析[J]. 肠外与肠内营养, 2017, 24(1): 33-36. DOI:10.16151/j.1007-810x.2017.01.009 |
| [95] | Schuetz P, Fehr R, Baechli V, et al. Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial[J]. Lancet, 2019, 393(10188): 2312-2321. DOI:10.1016/S0140-6736(18)32776-4 |
| [96] | Ma JY, Wan X, Liu JF, et al. Precision nutrition management in hyperlipidemia-associated acute pancreatitis: mechanistic insights and personalized therapeutic approaches[J]. Front Nutr, 2025, 12: 1583889. DOI:10.3389/fnut.2025.1583889 |
| [97] | Li H, Fang CL, Hu YS, et al. The comparative analysis of peptides in enteral nutrition products and foods for special medical purposes[J]. Foods, 2024, 13(16): 2557. DOI:10.3390/foods13162557 |
| [98] | Patel BK, Patel KH, Bhatia M, et al. Gut microbiome in acute pancreatitis: a review based on current literature[J]. World J Gastroenterol, 2021, 27(30): 5019-5036. DOI:10.3748/wjg.v27.i30.5019 |
| [99] | Ni YQ, Qian LL, Siliceo SL, et al. Resistant starch decreases intrahepatic triglycerides in patients with NAFLD via gut microbiome alterations[J]. Cell Metab, 2023, 35(9): 1530-1547.e8. DOI:10.1016/j.cmet.2023.08.002 |
| [100] | Wang R, Tang RQ, Li B, et al. Gut microbiome, liver immunology, and liver diseases[J]. Cell Mol Immunol, 2021, 18(1): 4-17. DOI:10.1038/s41423-020-00592-6 |
| [101] | Mo SJ, Lee K, Hong HJ, et al. Effects of Lactobacillus curvatus HY7601 and Lactobacillus plantarum KY1032 on overweight and the gut microbiota in humans: randomized, double-blinded, placebo-controlled clinical trial[J]. Nutrients, 2022, 14(12): 2484. DOI:10.3390/nu14122484 |
| [102] | Lauw S, Kei N, Chan PL, et al. Effects of synbiotic supplementation on metabolic syndrome traits and gut microbial profile among overweight and obese Hong Kong Chinese individuals: a randomized trial[J]. Nutrients, 2023, 15(19): 4248. DOI:10.3390/nu15194248 |
| [103] | 中华预防医学会微生态学分会. 中国微生态调节剂临床应用专家共识(2020版)[J]. 中国微生态学杂志, 2020, 008: 032. DOI:10.3760/cma.j.issn.1674-2397.2020.04.001 |
| [104] | 张丽艳, 吴战军, 裴长安, 等. 标准三联疗法和加用益生菌对幽门螺杆菌感染的疗效比较[J]. 中华消化杂志, 2013, 33(11): 770-772. DOI:10.3760/cma.j.issn.0254-1432.2013.011.016 |
| [105] | Faghih M, Drewes AM, Singh VK. Psychiatric disease susceptibility and pain in chronic pancreatitis: association or causation?[J]. Am J Gastroenterol, 2021, 116(10): 2026-2028. DOI:10.14309/ajg.0000000000001491 |
| [106] | 范瑞娟. 正念认知疗法对广泛性焦虑障碍患者的正念注意觉知、经验性回避、认知融合的干预研究[D]. 安徽医科大学, 2023. |
| [107] | 田代华. 实用中药辞典[M]. 北京: 人民卫生出版社, 2002. |
| [108] | Luo XW, Zhao MX, Zhang YL, et al. Effects of Baduanjin exercise on blood glucose, depression and anxiety among patients with type Ⅱ diabetes and emotional disorders: a meta-analysis[J]. Complement Ther Clin Pract, 2023, 50: 101702. DOI:10.1016/j.ctcp.2022.101702 |
| [109] | Kong LJ, Ren J, Fang ST, et al. Effects of traditional Chinese mind-body exercise-Baduanjin for type 2 diabetes on psychological well-being: a systematic review and meta-analysis[J]. Front Public Health, 2022, 10: 923411. DOI:10.3389/fpubh.2022.923411 |
| [110] | Mitchell AJ, Yadegarfar M, Gill J, et al. Case finding and screening clinical utility of the Patient Health Questionnaire (PHQ-9 and PHQ-2) for depression in primary care: a diagnostic meta-analysis of 40 studies[J]. BJPsych Open, 2016, 2(2): 127-138. DOI:10.1192/bjpo.bp.115.001685 |
| [111] | Ramírez-López G, Flores-Aldana M, Salmerón J. Associations between dietary patterns and metabolic syndrome in adolescents[J]. Salud Publica Mex, 2019, 61(5): 619-628. DOI:10.21149/9541 |
| [112] | Craig CL, Marshall AL, Sjöström M, et al. International physical activity questionnaire: 12-country reliability and validity[J]. Med Sci Sports Exerc, 2003, 35(8): 1381-1395. DOI:10.1249/01.MSS.0000078924.61453.FB |
| [113] | 高甘油三酯血症临床管理多学科专家共识工作组. 高甘油三酯血症临床管理多学科专家共识[J]. 中国循环杂志, 2023, 38(6): 621-633. DOI:10.3969/j.issn.1000-3614.2023.06.003 |
| [114] | 徐欣, 丁玲, 祝荫. 高三酰甘油血症性急性胰腺炎复发的研究进展[J]. 中华胰腺病杂志, 2025, 25(1): 68-72. DOI:10.3760/cma.j.cn115667-20241029-00178 |
| [115] | 李非, 王晓辉. 急性胰腺炎多学科诊治的经验与思考[J]. 中华外科杂志, 2015, 53(9): 649-652. DOI:10.3760/cma.j.issn.0529-5815.2015.09.003 |
| [116] | 苗毅, 奚春华. 构建明日之学科: 实时一体化多学科团队胰腺专科[J]. 中华消化外科杂志, 2024, 23(5): 642-646. DOI:10.3760/cma.j.cn115610-20240501-00233 |
 2025, Vol. 34
2025, Vol. 34