2. 北京大学人民医院创伤救治中心,北京 100044
2. Trauma Treatment Center, Peking University People's Hospital, Beijing 100044, China
创伤患者出现心脏损伤较常见,除直接胸部创伤导致的穿透性或钝性心脏损伤外,失血性休克、重症感染、全身强烈的炎症反应、应激等因素均可造成继发性心脏损伤。创伤患者早期往往存在血容量不足和严重的炎症反应,心脏代偿而出现高输出量,导致心功能不全的早期识别困难[1]。传统的二维超声心动图是目前最常用的、简便易行的评估左室收缩功能的方法,但该方法对早期、亚临床的心脏收缩功能障碍不敏感,不利于评估左心室整体运动情况,且受观察者间差异影响较大[2],故临床上创伤患者的心功能不全检出率不高。斑点追踪超声心动图(speckle tracking echocardiography, STE)是近年来发展起来的评估左室收缩功能的方法,该技术能够更加全面、客观、定量评估心肌运动。目前已有多项临床研究证实,STE能够在早期发现心肌损伤,对亚临床心功能不全诊断价值高[3]。其中左室整体纵向应变(global longitudinal strain, GLS),代表左室17个心肌节段的平均纵向应变,是评估左室收缩功能重复性最好的指标[4]。目前关于该方法对重症创伤患者心功能评价的临床研究较少,故本研究尝试在床旁应用STE-GLS评估创伤患者的左室收缩功能,并进一步探索其在判断预后中的价值。
1 资料与方法 1.1 研究对象纳入标准:⑴2020年9月1日至2021年4月1日期间连续来本院就诊并收入重症监护治疗的重症创伤患者(ISS评分≥16分);⑵年龄18~80岁,既往无严重的基础疾病;⑶入院距离创伤发病在24 h之内,并在发病24 h内能够完成超声心动图检查者;⑷病情允许进行床旁超声心动图检查,并且取得患者或授权家属的知情同意。
排除标准:⑴发病时间距离入院时间超过24 h,或因急救、急诊手术等无法完成床旁超声者;⑵既往存在严重的心脏基础疾病:如缺血性心脏病、先天性心脏病、中重度的心脏瓣膜病、收缩性和(或)舒张性心力衰竭等;⑶既往存在严重的全身性合并症:如未控制的高血压及糖尿病,恶性肿瘤,化疗史,肝硬化、慢性肾脏疾病、消化道疾病及颅脑病变(包括脑血管病及占位性病变)等疾病;⑷超声图像差,无法获得完整、清晰的动态二维超声心动图像者。
本研究为前瞻性队列研究,获得北京大学人民医院医学伦理委员会批准,伦理批号2022PHB111-001。
1.2 研究方法 1.2.1 收集数据收集符合条件的创伤患者的临床资料,包括一般人口学特征、受伤机制及部位、ISS评分、入院即刻的生命体征和实验室指标(血红蛋白、肌酐、乳酸及高敏肌钙蛋白Ⅰ等)。发病24 h内进行的心电图、超声及CT等检查,并记录重症监护时间、院内死亡/存活等信息。心电图异常包括心律失常及ST-T异常等[5]。左室收缩功能障碍定义为左室射血分数(left ventricular ejection fraction, LVEF) < 50%,左室整体纵向应变GLS > -15%。
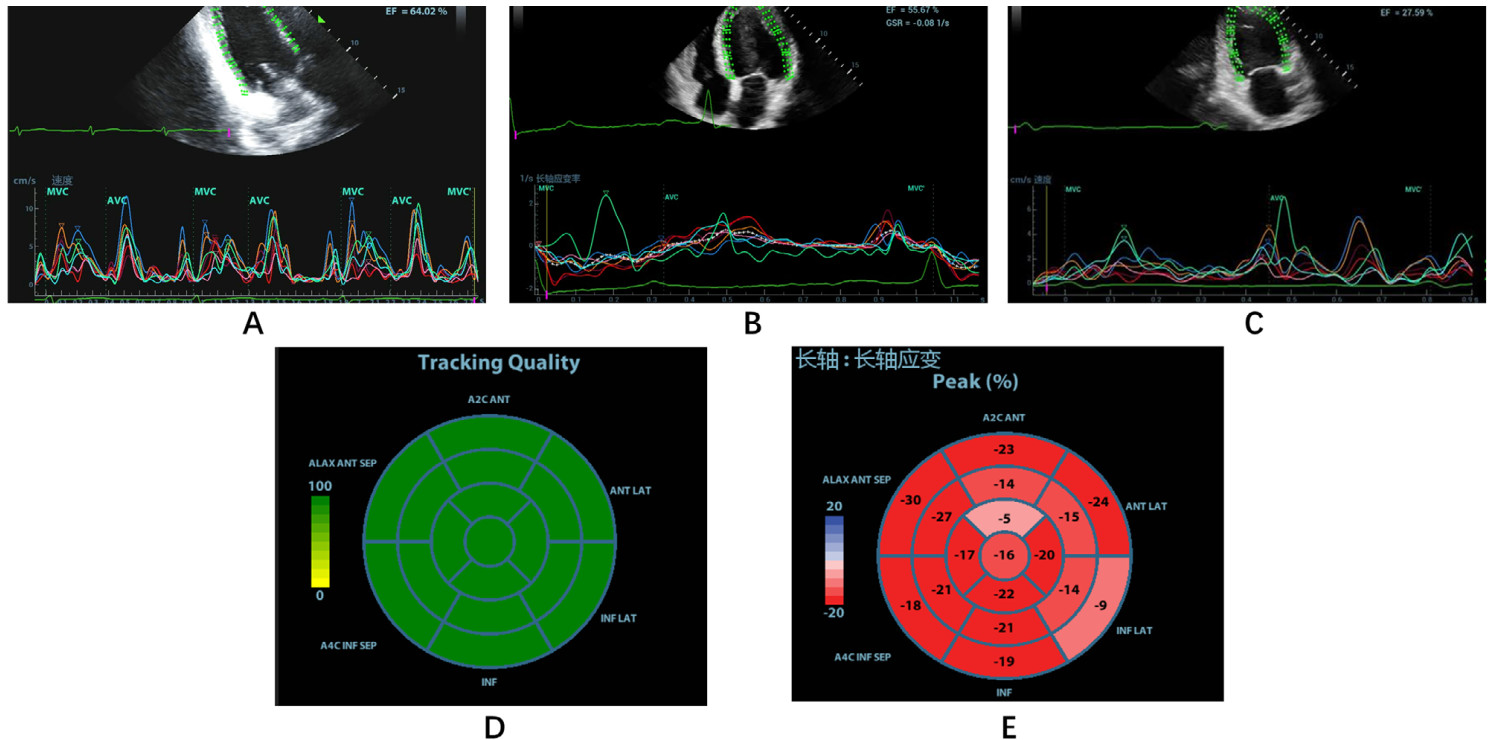
1.2.2 超声心动图检查纳入研究的患者均在发病24 h内行床旁超声心动图检查。采用迈瑞M9彩色多普勒超声诊断仪,应用SP5-1U探头,帧频40~80帧/s。连接心电图,常规超声心动图测量左室射血分数;然后连续采集标准左室长轴,心尖四腔及两腔心切面动态二维图像,存储动态图像并分析左室心肌纵向收缩期峰值应变,上述所有测量值均取3个心动周期平均值。某典型病例测量见图 1。
|
| 注:A:清晰的左室长轴动态图像,在二尖瓣环及心尖部的心内膜放置3个点(2个瓣环点和1个顶点)确定感兴趣区后,系统自动勾画出左室心内膜;B:用同样的方法,在动态的心尖四腔心图像上确定感兴趣区后,系统自动勾画出左室心内膜;C:在动态的两腔心图像上确定感兴趣区后,系统自动勾画出左室心内膜;D:如系统自动追踪结果欠佳则通过手动调整,使追踪更加准确,此图表示各个节段追踪质量好;E:追踪成功后得到左室心肌整体纵向收缩期峰值应变,并得到心肌应变牛眼图,此图即为牛眼图 图 1 斑点追踪超声心动图测量应变流程图 Fig 1 Flow chart of strain measurement of speckle tracking echocardiography |
|
|
本研究超声由经验丰富的医师根据美国超声心动图协会和欧洲心血管协会的指南进行[6]。数据测量由对病情不知情的专业医师采取离线方式进行。随机选择5例患者的图像(代表大约15%的患者),由另外的对该研究不知情的超声心动专家重复测量,以确定观察者间的变异性;在初次测量后的6周由原医师进行重复测量,以确定观察者内变异性。
1.2.3 数据分组及处理根据患者的左室GLS水平分为应变异常组(GLS > -15%)和正常组(GLS≤-15%)。对比分析两组的临床特点,进一步分析左室GLS是否与院内死亡及重症监护时间等预后相关。
1.3 统计学方法采用SPSS 22.0统计学软件处理数据,符合正态计量资料以均数±标准差(x±s)表示,两组间的参数对比采用两独立样本t检验。不符合正态分布的数据以中位数和四分位数[M(Q1, Q3)]表示,两组间Mann-Whitney U检验。计数资料两组间的比较采用χ2检验。连续变量的相关因素分析采取多重线性回归,以P < 0.05为差异有统计学意义。
2 结果本研究期间,共纳入创伤患者32例,年龄(56.94±12.70)岁,男性22例,女性10例,ISS评分(22.56±10.49)分。32例创伤患者的受伤机制中,车祸伤18例,坠落伤13例,刀刺伤1例,合并钝性胸部损伤患者17例,合并颅脑损伤患者13例。研究期间常规二维超声心动图检测出左室收缩功能异常(LVEF < 50%)患者1例,STE检测出左室收缩功能下降(左室GLS > -15%)患者13例。具体见表 1。
| 项目 | 数值 |
| 男性(例) | 22 |
| 年龄(岁)a | 56.94±12.70 |
| ISS评分(分)a | 22.56±10.49 |
| 入院心率(次/min)a | 89.34±16.21 |
| 收缩压(mmHg)a | 129.06±29.92 |
| 舒张压(mmHg)a | 74.66±14.75 |
| 血红蛋白(g/L)a | 112.53±29.23 |
| 肌酐(μmol/L)a | 77.63±24.69 |
| 乳酸(mmol/L)b | 1.75 (0.90, 2.95) |
| 休克指数a | 0.76±0.37 |
| Hs-TnI值(pg/mL)b | 8.10 (4.80, 24.25) |
| 左室射血分数(%)a | 65.68±5.82 |
| LVEF < 50%人数(例) | 1 |
| 平均GLS值(%)a | -15.03±2.52 |
| GLS > -15%人数(例) | 13 |
| 注:a为(x±s),b为M(Q1, Q3) | |
对比心肌应变异常与正常患者的临床特点,发现两组之间性别、年龄等方面差异无统计学意义(P > 0.05)。在受伤机制方面,应变正常组坠落/跌倒患者比例更高(63.16% vs. 7.69%, P < 0.05),回顾病例发现该例GLS异常患者为6 m以上高处坠落致伤,其余患者的坠落高度范围均在6 m以内。两组之间的ISS评分[(26.15±11.98)分vs. (20.11±8.832)分,P > 0.05]、乳酸水平[(2.50±1.96) mmol/L vs. (2.51±2.73) mmol/L, P > 0.05]及血红蛋白水平[(111.77±35.24) g/L vs. (113.05±25.34) g/L, P > 0.05]均差异无统计学意义。应变异常组的心率较快、休克指数也较高,但是两组之间差异并无统计学意义(P > 0.05)。应变异常组的平均收缩压较正常组显著降低[(115.85±29.59) mmHg vs. (138.11±27.30) mmHg,P < 0.05]。应变异常与正常两组的心电图异常患者比例(54.54% vs. 57.89%)及Hs-TnI值差异均无统计学意义(P > 0.05)。应变异常组患者的LVEF值较正常组更低[(61.98±6.26)% vs. (68.21±3.97)%, P < 0.05],应变异常组的应变值为-(12.54±1.42)%,其绝对值显著低于应变正常组的-(16.64±1.46)%(P < 0.05)。应变异常组的重症监护时间较正常组延长[(18.15±26.97) d vs. (9.95±6.83) d],但两组之间的差异并无统计学意义(P > 0.05)。本研究纳入创伤患者中死亡人数1例,死于后期的并发症,创伤早期并未发现应变异常。见表 2。
| 项目 | GLS异常组(n=13) | GLS正常组(n=19) | 统计值 | P值 |
| 男性(例) a | 11 (84.61) | 11 (57.89) | 3.600 | 0.058 |
| 年龄(岁) b | 56.84±10.38 | 57.00±14.35 | 1.224 | 0.974 |
| 高血压a | 2 (15.38) | 3 (15.79) | 0.200 | 0.655 |
| 糖尿病a | 1 (7.69) | 1 (5.26) | 1.200 | 0.273 |
| 车祸伤a | 12 (92.31) | 6 (31.58) | 2.000 | 0.157 |
| 坠落/跌倒a | 1 (7.69) | 12 (63.16) | 9.308 | 0.002 |
| 其他a | 0 (0.0) | 1 (5.26) | 0.806 | 0.369 |
| 钝性胸部损伤a | 7 (53.84) | 10 (52.63) | 0.529 | 0.467 |
| 颅脑损伤a | 5 (38.46) | 8 (42.11) | 0.692 | 0.405 |
| 心率(次/min) b | 94.77±23.11 | 85.63±18.17 | 1.54 | 0.221 |
| 收缩压(mmHg) b | 115.85±29.59 | 138.11±27.3 | 0.051 | 0.036 |
| 舒张压(mmHg) b | 72.54±18.78 | 76.11±11.58 | 2.904 | 0.511 |
| 休克指数b | 0.92±0.50 | 0.64±0.177 | 12.000 | 0.070 |
| ISS评分(分) b | 26.15±11.98 | 20.11±8.83 | 0.986 | 0.110 |
| 血红蛋白(g/L) b | 111.77±35.24 | 113.05±25.34 | 3.539 | 0.905 |
| 肌酐(μmol/L) b | 80.46±22.12 | 75.68±26.73 | 0.199 | 0.599 |
| 乳酸(mmol/L) b | 2.50±1.96 | 2.51±2.73 | 0.017 | 0.995 |
| Hs-TnI值(pg/mL) c | 7.4 (16.4, 49.7) | 4.7 (6.65, 19.75) | 147.000 | 0.240 |
| 左室收缩末容积(mL) b | 45.16±14.33 | 29.75±9.53 | 3.628 | 0.002 |
| 左室舒张末容积(mL) b | 115.91±28.27 | 92.32±24.51 | 0.012 | 0.027 |
| 左室射血分数(%) | 61.98±6.26 | 68.21±3.97 | 3.054 | 0.002 |
| LVEF≤50% a | 1 (9.09) | 0 (0.0) | 1.581 | 0.209 |
| 50% < LVEF < 60% a | 3 (23.08) | 0 (0.0) | 2.793 | 0.095 |
| 左室纵向应变(%)b | ||||
| 四腔心切面 | 12.82±1.91 | 16.01±2.83 | 2.031 | 0.001 |
| 三腔心切面 | 11.26±2.65 | 17.06±3.97 | 3.142 | < 0.001 |
| 两腔心切面 | 12.85±2.39 | 16.20±3.88 | 5.355 | 0.012 |
| 左室GLS(%)b | 12.54±1.42 | 16.64±1.46 | 0.221 | < 0.001 |
| 心电图异常人数a | 6 (46.15) | 11 (57.89) | 1.471 | 0.225 |
| 重症监护时间(d) b | 18.15±26.97 | 9.95±6.83 | 3.022 | 0.212 |
| 院内死亡例数a | 0 (0.0) | 1 (5.26) | 0.806 | 0.369 |
| 注:a为(例,%),b为(x±s),c为M(Q1, Q3) | ||||
进一步通过多重线性回归分析影响重症监护时间的因素,将年龄、ISS评分、乳酸水平、休克指数、Hs-TnI值、LVEF及左室GLS等可能与之相关的因素纳入模型,发现左室GLS及Hs-TnI为其独立影响因素(P < 0.05),见表 3。
| 指标 | 系数 | 标准误 | 标化系数 | 95%CI | P值 |
| 常数 | -29.189 | 7.206 | (-35.946, 24.774) | < 0.001 | |
| 左室GLS | 1.414 | 0.454 | 0.487 | (0.175, 3.155) | 0.004 |
| LVEF | -0.122 | 0.239 | 0.048 | (-0.937, 0.682) | 0.817 |
| Hs-TnI | 0.358 | 0.049 | 1.035 | (0.044, 1.085) | 0.044 |
| 乳酸 | 0.921 | 0.454 | 0.317 | (-1.033, 2.643) | 0.053 |
| ISS评分 | 0.164 | 0.104 | 0.239 | (-0.294, 0.349) | 0.129 |
本研究分别对比了观察者间及观察者内所测量数据的一致性,统计分析发现上述数据之间的差异并无统计学意义(P > 0.05)。
3 讨论STE是2004年出现的一种评价心脏功能的方法,与传统的超声心动图测量左室射血分数相比,STE直接测量心肌形变,受心室前后负荷变化的影响小。欧洲心血管影像协会、美国超声心动协会均认为该方法评估左室收缩功能更加客观,可重复性好,优于传统的超声心动参数[7]。对于STE的临床应用,正常值非常重要,但由于不同机器生产厂家应用不同的算法,目前正常值无法统一。美国超声心动图学会建议健康人的GLS峰值在-20%以下[6]。一项Meta分析发现GLS正常值在-15.9%到-22.1%[4],故本研究采用了-15%作为左室收缩功能障碍的临界值。
本研究共纳入32例重症创伤患者,常规超声心动图检测出左室收缩功能异常(LVEF < 50%)患者1例,而STE发现左室收缩功能下降(GLS > -15%)患者13例,说明在创伤患者中STE展现出较常规超声心动测量LVEF更敏感的优势,更有利于发现亚临床左室收缩功能受损。目前已有的临床研究,在化疗引起的心肌损伤[8]、射血分数保留的心力衰竭[9]、肥厚型心肌病等[10]疾病中,均认为STE-GLS可早期发现亚临床心肌损伤,能够较LVEF更敏感的识别左室收缩功能障碍。STE虽已逐渐成为科学的、成熟的、为人们所熟知的技术,但在创伤患者心脏评估方面的应用不多,2015年国内一项研究[11]进行了一项应用STE评估新西兰兔钝性心肌损伤的实验,结果常规超声心动图发现实验组与对照组动物的心肌收缩功能变化无统计学差异,而STE却发现打击4 h后实验动物的心肌即出现节段性的应变下降,证实了STE评价心肌损伤的科学性及有效性。目前STE在创伤患者中的临床应用主要是在颅脑损伤患者中[12-13]。
虽然目前的大多数临床研究认为STE-GLS能更敏感的发现亚临床心脏病变,但床旁STE对重症患者的临床研究还处于起步阶段[14]。2016年Ng等[15]对入住重症监护的脓毒症患者利用床旁超声进行了一项病例对照临床研究,发现研究组与对照组之间常规超声心动图LVEF上差异无统计学意义(59% vs. 61%, P=0.100),但研究组的GLS绝对值更低,证实床旁超声测量STE能较LVEFF更敏感的检测出左室收缩功能障碍。本研究利用床旁超声STE评价了重症监护的创伤患者的心功能,虽然未得到核磁、心脏造影等检查的进一步验证,但对创伤患者的紧急救治、快速心功能评估提供了一种安全而又及时有效的方法,具有非常重要的临床价值。总之,STE是一种可在重症患者床旁进行的非常实用高效的技术[14]。
本研究通过对比GLS异常与正常两组发现,GLS异常组的ISS评分较高,重症监护住院时间较长,但两组之间的差异并不具有统计学意义,可能与本研究案例数少存在选择偏移有关。另外本团队发现GLS异常组的LVEF均值也较低,提示两种检查方法之间可能存在相关性,既往Dalla等[12]进行的一项应用STE和LVEF评估蛛网膜下腔出血患者心功能的临床研究,发现LVEF与STE-GLS相关系数为0.62(P < 0.05),认为两种方法检查结果存在一定的相关性,但GLS较LVEF更较敏感。随着国家创伤中心的成立,本院对于重症创伤患者的救治水平大幅提高,死亡人数急剧下降。因死亡人数太少,故本研究探索了影响重症监护时长的相关因素,结果发现GLS及Hs-TnI是与之相关的独立危险因素。既往许多心血管疾病方面的临床研究,均认为GLS在预测心血管疾病结局[16]、病死率及心脏不良事件等方面均优于LVEF[17-19]。虽然目前尚无统一的判断不良预后的GLS临界值,但有临床研究认为GLS > -12%代表严重的收缩功能障碍和预后不良[17, 19]。ISS评分是判断创伤患者病情严重程度的重要参数,但本研究并未发现其与重症监护时长的相关,回顾病例发现ISS评分高者可能因为存活时间短造成重症监护时间短;还有部分评分高的重症患者,因为经济或者高龄等原因,治疗意愿不强,存在转院及放弃治疗等实际情况,最终影响了ISS评分对重症监护时间的影响。
综上所述,创伤患者发生心脏损伤及亚临床左室收缩功能障碍很常见,STE能较LVEF更加敏感的发现左室收缩功能障碍,即对早期发现创伤所致心脏损伤有重要意义。并且STE可以床旁进行,有利于临床对重症患者的心功能进行动态评估。本研究虽然样本量不大,但却是对重症创伤患者能在床旁更加精准的评估左心功能的可行性做出的初步探究。期待更多相关临床研究的出现,也期待床旁超声能够更好的运用于各类重症患者的救治过程。
利益冲突 所有作者声明无利益冲突
作者贡献声明 窦丽稳:研究设计、数据收集及论文撰写;叶菁菁:数据收集、统计分析、论文修改;黄伟、杜哲:病例帅选、统计分析;高伟波,迟骋:文献查询、分析、论文修改;王天兵:研究设计、论文修改
| [1] | Cryer HG, Leong K, McArthur DL, et al. Multiple organ failure: by the time you predict it, it's already there[J]. J Trauma, 1999, 46(4): 597-604. DOI:10.1097/00005373-199904000-00007 |
| [2] | Badano L, Stoian J, Cervesato E, et al. Reproducibility of wall motion score and its correlation with left ventricular ejection fraction in patients with acute myocardial infarction[J]. Am J Cardiol, 1996, 78(7): 855-858. DOI:10.1016/s0002-9149(96)00440-7 |
| [3] | Smiseth OA, Torp H, Opdahl A, et al. Myocardial strain imaging: how useful is it in clinical decision making?[J]. Eur Heart J, 2016, 37(15): 1196-1207. DOI:10.1093/eurheartj/ehv529 |
| [4] | Yingchoncharoen T, Agarwal S, Popović ZB, et al. Normal ranges of left ventricular strain: a meta-analysis[J]. J Am Soc Echocardiogr, 2013, 26(2): 185-191. DOI:10.1016/j.echo.2012.10.008 |
| [5] | Edouard AR, Felten ML, Hebert JL, et al. Incidence and significance of cardiac troponin I release in severe trauma patients[J]. Anesthesiology, 2004, 101(6): 1262-1268. DOI:10.1097/00000542-200412000-00004 |
| [6] | Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging[J]. J Am Soc Echocardiogr, 2015, 28(1): 1-39. e14. DOI:10.1016/j.echo.2014.10.003 |
| [7] | Farsalinos KE, Daraban AM, Ünlü S, et al. Head-to-head comparison of global longitudinal strain measurements among nine different vendors: the EACVI/ASE inter-vendor comparison study[J]. J Am Soc Echocardiogr, 2015, 28(10): 1171-1181. DOI:10.1016/j.echo.2015.06.011 |
| [8] | Sawaya H, Sebag IA, Plana JC, et al. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients[J]. Am J Cardiol, 2011, 107(9): 1375-1380. DOI:10.1016/j.amjcard.2011.01.006 |
| [9] | Hasselberg NE, Haugaa KH, Sarvari SI, et al. Left ventricular global longitudinal strain is associated with exercise capacity in failing hearts with preserved and reduced ejection fraction[J]. Eur Heart J Cardiovasc Imaging, 2015, 16(2): 217-224. DOI:10.1093/ehjci/jeu277 |
| [10] | Williams LK, Frenneaux MP, Steeds RP. Echocardiography in hypertrophic cardiomyopathy diagnosis, prognosis, and role in management[J]. Eur J Echocardiogr, 2009, 10(8): iii9-ii14. DOI:10.1093/ejechocard/jep157 |
| [11] | Du WH, Wang X, Xiong XQ, et al. Role of speckle tracking imaging in the assessment of myocardial regional ventricular function in experimental blunt cardiac injury[J]. Chin J Traumatol, 2015, 18(4): 223-228. DOI:10.1016/j.cjtee.2014.10.006 |
| [12] | Dalla K, Bech-Hanssen O, Oras J, et al. Speckle tracking-vs conventional echocardiography for the detection of myocardial injury-a study on patients with subarachnoid haemorrhage[J]. Acta Anaesthesiol Scand, 2019, 63(3): 365-372. DOI:10.1111/aas.13272 |
| [13] | Krishnamoorthy V, Chaikittisilpa N, Lee J, et al. Speckle tracking analysis of left ventricular systolic function following traumatic brain injury: a pilot prospective observational cohort study[J]. J Neurosurg Anesthesiol, 2020, 32(2): 156-161. DOI:10.1097/ANA.0000000000000578 |
| [14] | Orde S, Huang SJ, McLean AS. Speckle tracking echocardiography in the critically ill: enticing research with minimal clinical practicality or the answer to non-invasive cardiac assessment?[J]. Anaesth Intensive Care, 2016, 44(5): 542-551. DOI:10.1177/0310057X1604400518 |
| [15] | Ng PY, Sin WC, Ng AK, et al. Speckle tracking echocardiography in patients with septic shock: a case control study (SPECKSS)[J]. Crit Care, 2016, 20(1): 145. DOI:10.1186/s13054-016-1327-0 |
| [16] | Kalam K, Otahal P, Marwick TH. Prognostic implications of global LV dysfunction: a systematic review and meta-analysis of global longitudinal strain and ejection fraction[J]. Heart, 2014, 100(21): 1673-1680. DOI:10.1136/heartjnl-2014-305538 |
| [17] | Ersbøll M, Valeur N, Mogensen UM, et al. Prediction of all-cause mortality and heart failure admissions from global left ventricular longitudinal strain in patients with acute myocardial infarction and preserved left ventricular ejection fraction[J]. J Am Coll Cardiol, 2013, 61(23): 2365-2373. DOI:10.1016/j.jacc.2013.02.061 |
| [18] | Mignot A, Donal E, Zaroui A, et al. Global longitudinal strain as a major predictor of cardiac events in patients with depressed left ventricular function: a multicenter study[J]. J Am Soc Echocardiogr, 2010, 23(10): 1019-1024. DOI:10.1016/j.echo.2010.07.019 |
| [19] | Stanton T, Leano R, Marwick TH. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring[J]. Circ Cardiovasc Imaging, 2009, 2(5): 356-364. DOI:10.1161/CIRCIMAGING.109.862334 |
 2025, Vol. 34
2025, Vol. 34