2. 济南市儿童医院新生儿科, 济南 250022
2. Department of Neonatology, Jinan Children's Hospital, Jinan 250022, China
血浆置换(plasma exchange,PE)是儿童重症监护病房(pediatric intensive care unit,PICU)经常用到的一种血液净化方式,其通过膜式血浆分离器,去除血液循环中的致病物质,同时补充健康人血浆或人血白蛋白等物质[1]。体外循环通路的良好抗凝,是血液净化的基础。肝素是临床最为常用的抗凝剂,具有效果确切、价格低廉、容易获得、过量时可以使用鱼精蛋白中和等优点,但其存在增加出血倾向、肝素相关性血小板减少症等风险。局部枸橼酸抗凝(regional citrate anticoagulation,RCA)通过螯合体外循环的钙离子,阻断其凝血过程,具有良好的体外抗凝能力的同时,不影响体内凝血功能,已在连续静脉-静脉血液滤过(CVVH)、连续静脉-静脉血液透析(CVVHD)、连续静脉-静脉血液透析滤过(CVVHDF)等多种血液净化模式中广泛应用。但局部枸橼酸抗凝血浆置换(RCA-PE)临床研究相对较少。近年来本科在部分疾病PE治疗过程中,采用了RCA,现总结汇报如下。
1 资料与方法 1.1 研究对象选择2023年12月至2024年8月收入本院PICU并行RCA-PE治疗的患儿为研究对象。纳入标准:(1)因病情需要行PE;(2)抗凝方式为RCA;(3)血流动力学稳定。排除标准:(1)临床资料不完整;(2)存在局部枸橼酸抗凝禁忌证:严重肝功能衰竭、难以纠正的低氧血症和(或)组织灌注不足、严重代谢性酸中毒[2]。本研究为回顾性研究,仅从电子病历中提取数据,未侵犯患者的隐私和商业利益,获得了医院伦理委员会的批准(审批号:SDFE-IRB/T-2024091),并免除了知情同意的要求。
1.2 设备及材料血液净化机器为德国费森尤斯multiFiltrate,根据年龄、体重选择同厂家相应的管路与膜式血浆分离器。血管通路采用右侧颈内静脉或股静脉置入一次性使用无菌血液透析导管(艾贝尔,广东百合医疗科技股份有限公司,中国),并根据患儿年龄、体重及置管前血管超声评估,导管型号选择6.5~8.5 Fr。血气分析测定采用美国实验仪器公司血气分析仪(GEM Premier 3000-5700)。血清总钙(Total calcium,Catot)测定采用美国雅培全自动生化分析仪(ABBOTT ARCHITECT C16000)。活化凝血时间(activated clotting time of whole blood,ACT)测定采用美国美敦力ACT Plus自动凝血时间测定仪(ACT200)。抗凝剂选择抗凝血用枸橼酸钠溶液(trisodium citrate,TSC,成都青山利康药业,200 mL:8.0 g)。置换液选用同型病毒灭活冰冻血浆。
1.3 管路连接及治疗参数血液净化机引血端连接血液透析导管副管,回血端连接导管主管。选择CVVH模式,初设参数:血流速度(mL/min):3~5 mL/(kg·min),血液透析导管副管接三通泵入TSC,速度(mL/h):(1.2~1.5)×血流速度(mL/min),导管主管接三通泵入10%葡萄糖酸钙溶液,速度(mL/h):10%~15%×TSC速度(mL/h),置换液速度(分浆比):15%~20%,超滤速度:0 mL/h。置换总量(mL):65×体质量(kg)×(1-红细胞比容)[1]。
1.4 检测指标及判断标准12例患儿均检测了PE前(0 h)体内血气分析,以及治疗开始后0.5 h、治疗结束时的体内、体外管路(血浆分离器后)血气分析。部分患儿检测了治疗后4 h、6~8 h、12~15 h体内血气分析,以及治疗前后ACT、Catot变化。随机抽取15袋置换液(同型病毒灭活冰冻血浆)检测其血气分析、Catot。体外管路离子钙(ionized calcium,Caion)目标值为(0.2~0.4 mmol/L),体内Caion目标值(0.9~1.1 mmol/L)[3]。低钙血症定义为体内Caion < 0.85 mmol/L,或有手足抽搐等低钙症状。严重低钙血症不良事件(严重低钙血症)定义为体内Caion < 0.80 mmol/L,且伴有严重心律失常、呼吸困难等症状[4]。高钙血症定义为体内Catot > 2.75 mmol/L或体内Caion > 1.25 mmol/L。高钠血症定义为体内Na+ > 150 mmol/L、低钾血症定义为体内K+ < 3.5 mmol/L、高乳酸血症定义为体内乳酸 > 2.2 mmol/L,代谢性碱中毒定义为pH > 7.45且HCO3- > 27 mmol/L[5]。
1.5 抗凝效果及安全性判定动态观察体外管路各压力监测数值、管路凝血情况以评价抗凝效果。观察患儿治疗过程、结束12 h内有无出血倾向。并观察是否出现因Caion及酸碱平衡紊乱而出现呼吸困难、惊厥、心律失常等严重不良事件发生。
1.6 统计学方法应用R 4.3.1对数据进行统计分析。符合正态分布的计量资料采用均数±标准差(x±s)表示,多时间点的变量采用单组重复测量方差分析进行整体差异检验,并以0 h为参照,进行配对t检验作事后检验,P值采用Benjamini-Hochberg方法校正。两个时间点的变量,采用配对t检验比较。非正态分布的计量资料采用中位数和四分位数表示,多时间点的变量采用Frideman秩和检验进行整体差异检验,并以0 h为参照,进行Wilcoxon符号秩检验作事后检验,P值采用Benjamini-Hochberg方法校正。两个时间点的变量,采用Wilcoxon符号秩检验比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况共12名患儿入选,男性7例,女性5例(其中处于生理期1例),共行RCA-PE 28例次。年龄1.5~14岁(年龄中位数7.5岁),体重10.5~69 kg(体重中位数24 kg)。原发疾病自身免疫性脑炎5例,斯-琼综合征4例,血栓性血小板减少性紫癜2例,自身免疫性溶血1例。PE前体内血气分析、各电解质基线水平见表 1中0 h。
| 时点 | pHa | HCO3-a(mmol/L) | BEa(mmol/L) | Caiona(mmol/L) | PaCO2(mmHg) | K+(mmol/L) | Na+(mmol/L) | Lac(mmol/L) |
| 0 h | 7.46±0.04 | 27.24±3.35 | 3.41±3.53 | 1.19±0.07 | 38.50(34.00, 42.25) | 3.50(3.40, 3.73) | 135.00(133.00, 136.25) | 1.15(0.90, 2.02) |
| 0.5 h | 7.46±0.06 | 27.14±3.13 | 3.29±3.42 | 0.94±0.08 | 38.00(34.75, 42.25) | 3.35(3.10, 3.50) | 137.00(135.75, 138.25) | 1.40(1.07, 1.95) |
| 结束时 | 7.53±0.05 | 33.38±3.54 | 10.79±3.71 | 1.11±0.11 | 40.00(35.75, 43.50) | 3.20(3.10, 3.33) | 137.50(136.00, 140.00) | 1.75(1.40, 2.45) |
| 术后4 h | 7.50±0.05 | 32.12±3.87 | 8.91±4.38 | 1.22±0.09 | 42.00(40.25, 43.00) | 3.50(3.33, 3.80) | 138.00(135.25, 139.00) | 1.90(1.42, 2.70) |
| 术后6~8 h | 7.50±0.05 | 29.82±2.91 | 6.54±3.02 | 1.16±0.06 | 41.00(35.00, 43.00) | 3.70(3.30, 3.90) | 136.00(135.00, 138.00) | 1.40(1.12, 2.00) |
| 术后12~15 h | 7.47±0.04 | 27.48±3.69 | 3.89±3.90 | 1.16±0.05 | 38.00(34.25, 39.75) | 3.55(3.30, 3.70) | 136.00(134.00, 139.00) | 1.70(1.10, 2.20) |
| F/Q值 | 3.83 | 30.56 | 27.14 | 27.17 | 12.64 | 9.24 | 10.31 | 9.11 |
| P值 | 0.03 | <0.001 | <0.001 | <0.001 | 0.03 | 0.10 | 0.07 | 0.10 |
| 注:apH、HCO3-、BE、Caion符合正态分布,采用单组重复测量方差分析;其他变量为非正态分布,采用Frideman秩和检验 | ||||||||
初始血流速度(mL/min)3.26(3.04, 3.75) mL/(kg·min),结束时3.19(3.04, 3.75) mL/(kg·min),差异无统计学意义(P > 0.05);初始TSC速度(mL/h)/血流速度(mL/min)为1.24(1.20, 1.25),结束时为1.25(1.20, 1.27),差异无统计学意义(P > 0.05);初始10%葡萄糖酸钙速度(mL/h)/TSC速度(mL/h)为10.00(10.00, 12.00)%,结束时为11.80(10.00, 12.62)%,差异有统计学意义(P < 0.05)。见表 2。
| 时点 | Catota(mmol/L) | Catot/Caiona | 血流速度(mL/kg) | TSC/血流速度(mL/h)/(mL/min) | Ca/TSC(%) | ACTa(s) |
| 0 h | 2.13±0.14 | 1.84±0.12 | 3.26(3.04, 3.75) | 1.24(1.20, 1.25) | 10.00(10.00, 12.00) | 131.36±22.29 |
| 结束时 | 2.71±0.24** | 2.51±0.26 | 3.19(3.04, 3.75) | 1.25(1.20, 1.27) | 11.80(10.00, 12.62) | 134.82±16.74 |
| t/u值 | -10.52 | -10.43 | 3 | 13 | 7 | -0.77 |
| P值 | <0.001 | <0.001 | 0.37 | 0.93 | <0.001 | 0.45 |
| 注:aCatot、Catot/Caion、ACT符合正态分布,采用配对检验分析;其他变量为非正态分布,采用Wilcoxon符号秩检验;Ca/TSC为10%葡萄糖酸钙速度(mL/h)/TSC速度(mL/h) | ||||||
|
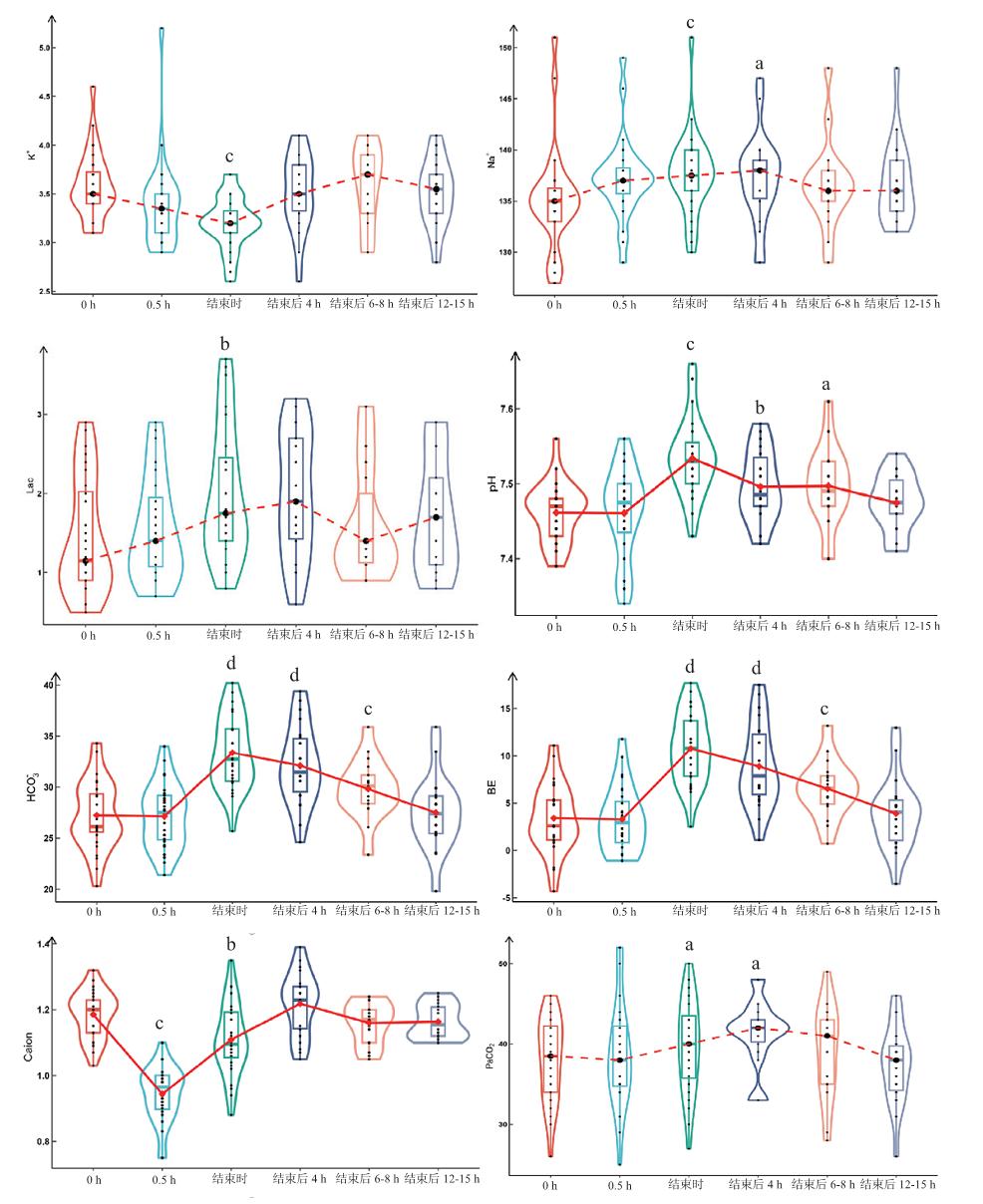
| 注:◆表示均值、●表示中位数。多重比较均以0 h为参照,配对t检验或Wilcoxon符号秩检验,P值采用Benjamini-Hochberg方法校正,a:P < 0.05,b:P < 0.01, c:P < 0.001,d:P < 0.0001 图 1 不同时间点数值分布及其变化趋势的小提琴图与箱式图 Fig 1 Violin and box plots of key parameter distributions and temporal trends |
|
|
(1)pH、HCO3-、BE:三者变化趋势基本相同。治疗0.5 h,较治疗前差异无统计学意义(P > 0.05);治疗结束时,增高达峰值,较治疗前差异有统计学意义(P < 0.05);治疗结束后4 h逐步降低,治疗结束12~15 h,恢复治疗前基线水平,差异无统计学意义(P > 0.05)。
(2)代谢性碱中毒例数:治疗前9例次,约32.1%。治疗结束时26例次,约92.9%。
(3)PaCO2:治疗结束时、治疗结束后4 h升高,与治疗前基线数值差异有统计学意义(P < 0.05)。
(4)K+:治疗结束时较治疗前基线数值降低,差异有统计学意义(P < 0.05)。
(5)Na+:治疗结束时、治疗结束后4 h较治疗前基线数值增高,差异有统计学意义(P < 0.05),但仍在正常值范围内。
(6)乳酸:治疗结束时较治疗前基线数值增高,差异有统计学意义(P < 0.05)。
(7)体内、外Caion:治疗0.5 h、结束时体内Caion较治疗前基线数值降低,差异有统计学意义(P < 0.05),但呈逐步增高趋势。治疗0.5 h出现低钙血症3例,其中1例数值为0.75 mmol/L,但均无临床表现。治疗期间,管路Caion均值在目标范围,5例次 < 0.2 mmol/L, 1例次 > 0.4 mmol/L。
(8)Catot、Catot/Caion:初始体内Catot为(2.13±0.14)mmol/L,结束时为(2.71±0.24)mmol/L,差异有统计学意义(P < 0.05);初始Catot/Caion为(1.84±0.12),结束时(2.51±0.26),差异有统计学意义(P < 0.05),结束时Catot/Caion > 2.5有6例次。
(9)置换液(同型病毒灭活冰冻血浆)中枸橼酸含量及其血气分析、Catot数值:本院血浆制品为100 mL血液保存液采集全血约400 mL后制备。每1000 mL血液保存液含枸橼酸(C6H8O7·H2O)4.8 g、枸橼酸钠(C6H5Na3O7·2H2O)13.2 g、葡萄糖(C6H12O6·1H2O)14.7 g。以献血者红细胞压积40%计算的话,最终血浆中枸橼酸浓度为20 mmol/L左右,与既往文献结果相似[6]。其血气分析、Catot数值见表 3。
| 数值 | pH | PaCO2(mmHg) | HCO3-(mmol/L) | BE(mmol/L) | K+a(mmol/L) | Na+(mmol/L) | Lac(mmol/L) | Caion(mmol/L) | Catota(mmol/L) |
| MAX | 7.57 | 57 | 16.00 | -11.30 | 6.90 | 135 | 4.10 | - | 1.59 |
| Mean | 7.30 | 29 | 12.35 | -14.11 | 3.66 | 129.87 | 1.97 | - | 1.46 |
| Median | 7.36 | 20 | 12.30 | -14.20 | 3.00 | 130 | 1.90 | - | 1.49 |
| MIN | 7.02 | 10 | 8.40 | -17.20 | 2.30 | 126 | 0.40 | - | 1.17 |
| 注:a非正态分布;-表示数值测不出 | |||||||||
除1例次因体外管路静脉压增高而提前结束治疗外,剩余27例次均完成操作,体外管路抗凝效果确切。所有患者无出血倾向加重趋势,其中1例处于生理期女童,顺利完成3次RCA-PE,阴道流血未见加重。22例次操作前测ACT为(131.36±22.29)s,结束时为(134.82±16.74)s,差异无统计学意义(P > 0.05,表 2),提示RCA-PE不影响体内凝血功能。所有患者未见明显临床不良事件发生,生命体征平稳。
3 讨论PE是临床常用的一种血液净化模式,良好抗凝是PE的基础。理论上理想的抗凝剂应具备以下特点:(1)剂量小,维持体外循环有效时间长;(2)不影响或可改善体外管路的生物相容性;(3)抗血栓作用强而抗凝作用弱;(4)药物作用时间短,且抗凝作用局限在体外管路;(5)监测手段简单、方便,适合床旁进行;(6)过量时有拮抗剂;(7)长期使用无严重不良反应[7]。目前尚无符合以上全部标准的理想抗凝剂,PE的抗凝以系统性肝素抗凝(systemic heparin anticoagulation,SHA)为主。但危重患者常合并凝血功能障碍,置管等有创操作多,且作为自身免疫性疾病高发人群的青春期及成年女性,存在生理期,肝素作为全身抗凝剂,有增加出血的风险。枸橼酸是一种体外抗凝剂,既往多用于CVVH、CVVHD、CVVHDF等血液净化模式,RCA用于PE,特别是儿童PE报道少,本研究总结了本院近1年来RCA-PE患儿的临床资料,以期为该治疗方法的有效性、安全性提供经验。
Caion(凝血因子Ⅳ)参与凝血的全过程。RCA可明显降低体外循环Caion水平,抑制凝血级联反应,达到体外抗凝效果。完成血浆分离后剩余的枸橼酸钙回到体内,通过三羧酸循环,释放出螯合的Caion,同时静脉端注入葡萄糖酸钙/氯化钙,体内Caion水平维持正常,不影响体内凝血功能。国内外已有大量研究[8-15]证明了RCA在成人/儿童CVVH等血液净化模式中的安全性及有效性,认为RCA在延长滤器寿命、降低出血并发症等方面优于SHA。而RCA在PE中应用的研究较少。吴道诩等[4]回顾性分析了53例次RCA-PE患者临床资料,无1例因体外管路凝血而提前终止治疗,提示抗凝效果良好。Reis等[16]为1例因子宫内膜增生继发活动性出血入院的患者实施了5次RCA-PE,未发生滤器凝血,阴道出血没有恶化。本院本组患儿中,1例14岁患血栓性血小板减少性紫癜的女童,入院时处于生理期,RCA下行PE 3次,亦未见阴道出血加重。其余患儿未见出血倾向,其中有22例次监测了PE前后的ACT,差异无统计学意义。Christiadi等[17]在一项5例患者36次RCA-PE的研究中,观察到体外管路凝血率低,约5%左右,与本院观察结果相近。近年来已有学者观察了儿童SHA-PE和RCA-PE的滤器凝血情况,认为RCA-PE组的总体滤器性能不次于或优于SHA-PE组[5, 18]。综合既往文献及本院观察,我们认为RCA-PE可以在不影响体内凝血功能的前提下,实现理想的体外管路抗凝。同时,应注意到——与SHA不同,RCA的抗凝效果具有“即刻性”,即当动脉端持续泵入枸橼酸,体外管路内钙离子达到目标值时,可实现体外管路的抗凝;当因各种原因导致动脉端枸橼酸泵入停止,体外管路的抗凝作用则立即消失。故临床操作过程中,应尽量保持枸橼酸泵入的连续性,以避免因枸橼酸泵入突然停止而导致的体外管路凝血风险增加。
虽然已有相关研究证明了RCA在PE中的有效性,并且作为人体内天然存在的一种生理性物质,枸橼酸本身不具有毒性及抗原性,生物相容性好[19-20]。但由于PE时枸橼酸清除率较低,且作为置换液的血浆本身即含有大量枸橼酸,以上特点增加了人体枸橼酸负荷及代谢紊乱的风险[21]。本院本组患儿在治疗过程中亦出现了不同程度的代谢紊乱,但未见明显临床不良反应,且PE结束后,代谢紊乱可自行恢复。现结合文献,将我科观察到代谢紊乱情况汇总分析如下:
(1)代谢性碱中毒:代谢性碱中毒是RCA常见的不良反应,其发生机制与过多碱性物质的摄入以及枸橼酸钙清除障碍有关[22]。RCA-PE时,代谢性碱中毒因置换液种类、枸橼酸用量、原发病不同等因素,发生率和程度不同。Yuan等[23]回顾性分析了255例PE患者,其中93例予RCA,治疗结束时HCO3-水平从(22.8±2.3)mmol/L升至(26.4±3.5)mmol/L(P =0.01)。一项研究[24]比较了血栓性血小板减少性紫癜和重症肌无力患者RCA-PE时碱中毒的发生率,发现血栓性血小板减少性紫癜组患者发生率更高,约93%的患者至少经历了1次代谢性碱中毒。Zhang等[5]对比了79例次不同抗凝方式PE患儿的临床资料,发现治疗2 h后,SHA组(49例)、RCA组(30例)患儿的pH和HCO3-水平均增高,但RCA组更明显,其代谢性碱中毒发生率48.3%,而SHA组仅为4.2%(P < 0.001)。Antonic等[25]观察了RCA-PE时不同置换液所导致的内环境变化,发现不论白蛋白组还是新鲜冰冻血浆组,治疗结束时pH、HCO3-均增高,但新鲜冰冻血浆组HCO3-增加更明显,且由于多次连续PE,新鲜冰冻血浆组pH、HCO3-基线水平高于白蛋白组。本科28例次RCA-PE患儿的观察结果与既往文献结果基本相同。故结合文献及本科观察,笔者认为以冰冻血浆作为置换液行RCA-PE,治疗结束时pH、HCO3-、BE增高不可避免;是否出现失代偿性代谢性碱中毒,可能与枸橼酸用量、原发病种类、治疗前机体内环境基线水平等有关;治疗结束12~15 h左右,pH、HCO3-、BE数值逐步降低,恢复至治疗前基线水平。
(2)血钙异常:钙代谢紊乱也是RCA-PE的并发症之一。笔者观察到体内Caion降低多出现于治疗初期,随治疗时间延长,体内Caion逐渐增高。治疗前后,部分患者比较了体内Catot浓度,治疗结束时Catot增高,较治疗前差异有统计学意义。笔者分析其原因,考虑与以下几点因素有关:①治疗初期体外管路抗凝所用的枸橼酸、血浆中的枸橼酸进入体内,与体内Caion鳌合呈枸橼酸钙,Caion降低;②治疗初期机体代谢枸橼酸钙尚不充分,其代谢后释放的Caion与补充的葡萄糖酸钙不足以补充被螯合以及经滤器丢失的Caion;③随治疗进行,机体代谢枸橼酸钙释放的Caion增多,体内Caion增高趋势;④治疗期间,补充葡萄糖酸钙,其目的既要补充经滤器丢失的钙,又要补充枸橼酸螯合的Caion,以维持体内Caion基本正常,即补钙量大于失钙量,故治疗结束时体内Catot浓度高于治疗前;⑤治疗结束,不再有枸橼酸进入体内,也不再经滤器丢失钙,而体内残留枸橼酸钙仍继续被代谢并释放出Caion,Caion浓度继续增高。虽然本组部分患者治疗初期出现了Caion降低,但所有患者均未出现惊厥、心律失常等低钙血症相关不良反应,与既往研究观点相同[26]。故考虑治疗初期出现的低钙血症,为大量枸橼酸进入体内、机体代谢枸橼酸钙尚不充分所导致,为一过性表现;且当体内Caion大于0.8 mmol/L时,无明显临床症状[26];随治疗时间延长,机体代谢枸橼酸钙增多,体内Caion水平会逐步增高。
(3)高乳酸血症:丙酮酸在乳酸脱氢酶作用下生成乳酸,此反应可逆。在有氧代谢情况下,丙酮酸依次转化成乙酰辅酶A、柠檬酸(枸橼酸)进入三羧酸循环。根据是否由组织缺氧引起,可将高乳酸血症分为两类,A型(组织缺氧型): 丙酮酸生成乳酸过多,B型(无组织缺氧型):乳酸转化成丙酮酸过少。Zhang等[5]观察了79例不同抗凝方式的PE患儿,其中SHA-PE组(49例)高乳酸血症发生率为6.2%, RCA-PE组(30例)高乳酸血症发生率为5%,其将高乳酸血症原因归结为循环问题,但未说明患儿是否存在循环障碍。本院本组部分患儿在治疗期间也出现了高乳酸血症,但未发现循环障碍的病因、临床表现,故考虑高乳酸血症原因可能与大量枸橼酸进入体内,干扰机体正常乳酸代谢及三羧酸循环有关。且治疗期间无酸中毒表现,停止枸橼酸输注后乳酸数值逐步恢复,临床无需特殊处理。
(4)Na+及K+:4%枸橼酸钠溶液中Na+浓度为408 mmol/L,远高于正常人体血钠正常水平。RCA-PE时,应观察是否出现高钠血症。本组患者治疗期间动态监测血钠水平,发现血钠水平轻度增高,但仍在正常范围,与既往研究结果[4-5]类似。相较于高钠血症,笔者观察到治疗期间患儿低钾血症发生率较高,既往文献报道较少,机制不明。本科随机留取15份置换用血浆样本行血气分析检验,其K+浓度2.30~6.90 mmol/L,均值3.66 mmol/L,考虑PE期间钾丢失大于钾补充可能不是低钾血症的唯一原因。故在RCA-PE过程中,应密切监测体内K+水平,酌情补钾,以防止低钾血症。
(5)枸橼酸蓄积(citrate accumulation, CA):Liu等[3]指出,CA是RCA行连续肾脏替代治疗(continuous renal replacement therapy, CRRT)的一种罕见且致命的并发症,但其较高的病死率可能主要是由于严重的共病,而不是CA本身。目前临床常用Catot/Caion来作为CA的预警指标,且比值≥2.5通常表明存在显著的CA[3]。Dmytro等[27]回顾性分析了1 070名RCA-CRRT患者,其中32名患者出现了CA,总发生率为2.99%,病死率100%。与RCA-CRRT时CA的低发生率、高病死率不同,RCA-PE时由于本身清除率较低,且作为置换液的血浆中含有较多枸橼酸等因素,CA发病率较高。Sébastien等[28]观察了47例次RCA-PE治疗前后患者的血钙变化,发现治疗前患者体内Catot及Caion水平分别为(2.04±0.14)mmol/L、(1.00±0.1)mmol/L,治疗结束时分别为(2.58±0.25)mmol/L、(1.02±0.07)mmol/L,治疗结束时Catot/Caion比值为(2.53±0.28)。本科28例次RCA- PE,操作结束时Catot/Caion比值为(2.51±0.26),有6例次Catot/Caion > 2.5,CA发生率约21.4%,但患者生命体征平稳,无死亡病例。故考虑对于RCA-PE患儿,Catot/Caion≥2.5这一单独指标,仅提示体内枸橼酸及其混合物增多,而不能作为病情危重的充分必要指标,亦不能作为停用RCA的标准,Liu等[3]指出,CA的发生并不意味着抗凝方式必须改变,通过降低枸橼酸混合物负荷,RCA可以成功治疗相当多的患者。枸橼酸对人体无毒,其对机体的危害在于过量枸橼酸导致的严重低钙血症[29]。结合文献及本科体会,笔者将CA分为以下两种:(1)伴有微循环障碍的CA(枸橼酸代谢障碍):本类患者因严重原发病导致微循环缺血缺氧,三羧酸循环严重、广泛障碍,进入体内的枸橼酸及其混合物不能被代谢,临床表现为Caion降低、补钙量增加、Catot/Caion增高、高AG性代谢性酸中毒等,此类患者原发病危重、氧代谢障碍,预后差,不适宜RCA;(2)不伴肝功能异常及微循环障碍的CA(枸橼酸摄入过多):本类患儿机体代谢枸橼酸能力正常,当大量枸橼酸及其混合物进入体内,Caion可一过性降低,补钙需求、Catot及Catot/Caion增加,但随枸橼酸及其混合物被代谢以及调整补钙速度,Caion逐步恢复正常水平,pH及HCO3-升高。此类患者虽然Catot/Caion增加,但CA导致严重低钙血症的可能性小,行RCA安全性高。
结合文献及本科观察结果,笔者认为对于儿童PE,目前尚无完美的抗凝剂,SHA、RCA都有其各自的优缺点。RCA可以作为儿童PE抗凝的一种选择,特别是对于高出血风险的患儿。代谢紊乱在儿童RCA-PE中常见,但多无明显临床不良反应,且在治疗后12~15 h可自行恢复。同时,有研究[5]表明,RCA-PE患儿序贯给予CVVHDF治疗4 h后,pH、HCO3-显著降低,代谢性碱中毒发生率从48.3%降至13.8%,为减轻RCA-PE患儿的代谢紊乱提供了新的方法。
本研究的局限性主要包括单中心设计和小样本量,可能限制结果的普适性。然而这些限制并不影响本研究的主要目的,即探索性分析儿童RCA-PE的有效性和安全性,特别是为高出血风险患儿的PE提供一种新的抗凝方法。未来需要多中心随机对照试验,进一步优化RCA在儿童PE中的实施方案。
利益冲突 所有作者声明无利益冲突
作者贡献声明 党伟、张凡:实验操作、论文撰写;李云霞、陈捷、林霞、张素芳、鲁伟峰:数据收集及整理、统计学分析;党伟、张凡:研究设计、论文修改
| [1] | 中国医师协会儿科医师分会血液净化专业委员会, 吴玉斌, 沈颖. 儿童血浆置换临床应用专家共识[J]. 中华实用儿科临床杂志, 2018, 33(15): 1128-1135. DOI:10.3760/cma.j.issn.2095-428X.2018.15.003 |
| [2] | Khwaja A. KDIGO clinical practice guidelines for acute kidney injury[J]. Nephron Clin Pract, 2012, 120(4): c179-c184. DOI:10.1159/000339789 |
| [3] | Liu SY, Xu SY, Yin L, et al. Management of regional citrate anticoagulation for continuous renal replacement therapy: guideline recommendations from Chinese emergency medical doctor consensus[J]. Mil Med Res, 2023, 10(1): 23. DOI:10.1186/s40779-023-00457-9 |
| [4] | 吴道诩, 贾晓玉, 谭颖, 等. 局部枸橼酸钠抗凝在单重血浆置换中的临床应用[J]. 中华肾脏病杂志, 2020, 36(11): 866-869. DOI:10.3760/cma.j.cn441217-20200302-00150 |
| [5] | Zhang XP, He J, Yao ZY, et al. Citrate anticoagulation in plasma exchange followed by continuous renal replacement therapy in critically ill children[J]. Int J Artif Organs, 2024, 47(2): 85-95. DOI:10.1177/03913988231223375 |
| [6] | van der Meulen J, Janssen MF, Oe PL. Cardiac arrest during rapid plasma exchange for haemolytic uraemic syndrome[J]. Nephrol Dial Transplant, 1994, 9(12): 1841. |
| [7] | 孙仁华. 血液滤过的抗凝治疗[J]. 中国实用外科杂志, 2008, 28(6): 439-440. DOI:10.3321/j.issn:1005-2208.2008.06.008 |
| [8] | Kindgen-Milles D, Brandenburger T, Dimski T. Regional citrate anticoagulation for continuous renal replacement therapy[J]. Curr Opin Crit Care, 2018, 24(6): 450-454. DOI:10.1097/MCC.0000000000000547 |
| [9] | 贺杰, 杨梅雨, 袁远宏, 等. 枸橼酸钠抗凝在儿童血液净化中的有效性与安全性研究[J]. 临床急诊杂志, 2018, 19(10): 667-672. DOI:10.13201/j.issn.1009-5918.2018.10.004 |
| [10] | Liu C, Mao Z, Kang HJ, et al. Regional citrate versus heparin anticoagulation for continuous renal replacement therapy in critically ill patients: a meta-analysis with trial sequential analysis of randomized controlled trials[J]. Crit Care, 2016, 20(1): 144. DOI:10.1186/s13054-016-1299-0 |
| [11] | 冯璇璘, 邓磊, 张洋, 等. 连续性肾脏替代治疗中局部枸橼酸抗凝与全身肝素抗凝比较的Meta分析[J]. 中华危重病急救医学, 2020, 32(8): 982-987. DOI:10.3760/cma.j.cn121430-20200122-00068 |
| [12] | 高建平, 王峰, 王勇刚, 等. RCA—CRRT在高出血风险急性肾损伤患者中的初步研究[J]. 中华急诊医学杂志, 2017, 26(9): 1020-1026. DOI:10.3760/cma.j.issn.1671-0282.2017.09.009 |
| [13] | Buccione E, Bambi S, Rasero L, et al. Regional citrate anticoagulation and systemic anticoagulation during pediatric continuous renal replacement therapy: a systematic literature review[J]. J Clin Med, 2022, 11(11): 3121. DOI:10.3390/jcm11113121 |
| [14] | Atis SK, Duyu M, Karakaya Z, et al. Citrate anticoagulation and systemic heparin anticoagulation during continuous renal replacement therapy among critically-ill children[J]. Pediatr Res, 2024, 96(3): 702-712. DOI:10.1038/s41390-024-03163-x |
| [15] | Sık G, Demirbuga A, Annayev A, et al. Regional citrate versus systemic heparin anticoagulation for continuous renal replacement therapy in critically ill children[J]. Int J Artif Organs, 2020, 43(4): 234-241. DOI:10.1177/0391398819893382 |
| [16] | Reis T, Ramos de Freitas GR, Reis F, et al. Regional hypertonic citrate anticoagulation in membrane therapeutic plasma exchange: a case series[J]. Can J Kidney Health Dis, 2021, 8: 20543581211054736. DOI:10.1177/20543581211054736 |
| [17] | Christiadi D, Mercado C, Singer R. Regional citrate anticoagulation in membrane based plasma exchange: Safety, efficacy and effect on calcium balance[J]. Nephrology (Carlton), 2018, 23(8): 744-747. DOI:10.1111/nep.13088 |
| [18] | 寻劢, 张良, 李志辉, 等. 局部枸橼酸抗凝在儿童单重血浆置换中的应用研究[J]. 中国血液净化, 2024, 23(10) 763-766, 789. DOI:10.3969/j.issn.1671-4091.2024.10.007 |
| [19] | 乐伟波, 龚德华. 枸橼酸的代谢动力学及其在连续性血液净化中的应用[J]. 肾脏病与透析肾移植杂志, 2009, 18(4): 363-366. DOI:10.3969/j.issn.1006-298X.2009.04.014 |
| [20] | Bos JC, Grooteman MP, van Houte AJ, et al. Low polymorphonuclear cell degranulation during citrate anticoagulation: a comparison between citrate and heparin dialysis[J]. Nephrol Dial Transplant, 1997, 12(7): 1387-1393. DOI:10.1093/ndt/12.7.1387 |
| [21] | 唐小琰, 陈德政, 张凌, 等. 局部枸橼酸抗凝在血液净化领域中的应用进展[J]. 中华肾脏病杂志, 2021, 37(6): 534-538. DOI:10.3760/cma.j.cn441217-20200908-00081 |
| [22] | 唐晗琪, 崔庆宏, 石靖, 等. 枸橼酸局部抗凝持续肾脏替代的代谢性碱中毒——一项单中心回顾性研究[J]. 中华急诊医学杂志, 2025, 34(2): 220-225. DOI:10.3760/cma.j.issn.1671-0282.2025.02.014 |
| [23] | Yuan F, Li Z, Li XJ, et al. Application of regional citrate anticoagulation in membrane therapeutic plasma exchange[J]. Int Urol Nephrol, 2020, 52(12): 2379-2384. DOI:10.1007/s11255-020-02581-0 |
| [24] | Marques MB, Huang ST. Patients with thrombotic thrombocytopenic purpura commonly develop metabolic alkalosis during therapeutic plasma exchange[J]. J Clin Apher, 2001, 16(3): 120-124. DOI:10.1002/jca.1022 |
| [25] | Antonic M, Gubensek J, Buturović-Ponikvar J, et al. Comparison of citrate anticoagulation during plasma exchange with different replacement solutions[J]. Ther Apher Dial, 2009, 13(4): 322-326. DOI:10.1111/j.1744-9987.2009.00733.x |
| [26] | Aguilera IM, Vaughan RS. Calcium and the anaesthetist[J]. Anaesthesia, 2000, 55(8): 779-790. DOI:10.1046/j.1365-2044.2000.01540.x |
| [27] | Khadzhynov D, Schelter C, Lieker I, et al. Incidence and outcome of metabolic disarrangements consistent with citrate accumulation in critically ill patients undergoing continuous venovenous hemodialysis with regional citrate anticoagulation[J]. J Crit Care, 2014, 29(2): 265-271. DOI:10.1016/j.jcrc.2013.10.015 |
| [28] | Kissling S, Legallais C, Pruijm M, et al. A new prescription model for regional citrate anticoagulation in therapeutic plasma exchanges[J]. BMC Nephrol, 2017, 18(1): 81. DOI:10.1186/s12882-017-0494-9 |
| [29] | Monchi M. Citrate pathophysiology and metabolism[J]. Transfus Apher Sci, 2017, 56(1): 28-30. DOI:10.1016/j.transci.2016.12.013 |
 2025, Vol. 34
2025, Vol. 34