2. 东北大学医学与生物工程信息学院, 沈阳 110000;
3. 北部战区总医院急诊医学科, 沈阳 110000
意外性低体温(accidental hypothermia, AH)是指在寒冷环境下,核心温度持续下降至35℃以下,全身代谢功能降低,伴有呼吸、循环、消化等多系统功能异常的症状[1]。近年来,随着冰雪运动的兴起、海上作业的增加、寒区军事活动的频繁,AH的发病率呈上升趋势[2]。但其致病机制与病理生理过程仍不明确,临床上亦缺乏有效的预防与治疗措施。因此,建立一个稳定、可重复,且与临床过程高度接近的动物模型对于AH的研究至关重要。目前,AH模型多使用啮齿类动物,常用于低温/复温治疗、低温炎症反应探索、低温心脏电/机械生理改变等研究领域。造模方式主要包括低温冷水浸泡法、肠内U型管置入联合低温平台降温法、人工气候箱法。本文针对以上模型的建立方法与特点进行综述,以期为不同研究目标下合理选择建模方式提供参考与依据。
1 文献来源本综述以“全身性冷损伤”、“意外性低体温”、“低温症”等作为关键词,在PubMed及中国知网进行文章名/关键词/摘要联合检索,时间限定为2014年3月至2024年12月,排除临床研究、细胞研究、体外研究,仅保留AH相关动物实验,经筛选后共有文章33篇,其中英文19篇,中文14篇。以下就文献中AH模型的建立方法、AH研究现状、模型特点等进行整理。
2 AH动物模型建立方法 2.1 肠内U型管置入联合低温平台降温法肠内U型管置入联合低温平台降温法多以大鼠作为研究对象,常用于探索AH降温/复温过程中心脏电/机械生理功能改变[3-8]。为保证研究过程的持续性与稳定性,该动物模型构建过程中需要对大鼠进行麻醉[戊巴比妥钠50 mg/kg,连续输注7.5 mg/(kg·h)直至核心温度降至30℃]。同时,为了控制单一变量并精确测定核心温度,通常也进行气管插管,以便在必要时进行机械通气。在大鼠麻醉后,以仰卧位固定于铝制空心平台上,平台内部辅以冷水循环(4~10 ℃)。同时,将U型管自直肠置入。肠内U型管一般为聚乙烯材质,内部同样以冷水循环。
若使用此模型进行低温复温过程中的心肌机械功能研究,通常将大鼠核心温度维持在15℃ 30 min左右,而后进行复温。多项研究显示该条件下心肌功能前后差异较大,实验结果阳性率较高[5, 7]。此外,在Saczkowski等[8]的研究中发现,构建该模型进程超150 min后,大鼠核心温度将下降至15℃左右并容易诱发心脏骤停。
2.2 低温冷水浸泡法以低温冷水浸泡法构建AH模型,多用于探索体温后降效应与低温/复温过程中多脏器、系统功能损伤情况[9-13]。该模型常用于模拟落水者的AH,多数以大鼠作为研究对象,也有部分研究使用巴马猪等大型动物[14-16]。该模型通常不进行气管插管操作,大鼠在造模前需禁食12 h,而后用耳棒和牙托固定在特制的装置内(多为立式框架鼠笼)。将鼠笼置于装有冷水的保温箱中,水温维持在15℃左右[12-13, 17]。保持水位与大鼠胸骨齐平,同时保证头部露出水面以避免误吸。核心温度一般通过肛温或肝下置入温度传感器的方式进行测定。使用巴马猪等大型动物造模时,由于其脂肪层较厚,通常将保温装置中的冷水控制在0~4 ℃左右以加快实验进程[15, 18]。同时,因其体型较大,肺动脉导管置入测温反而相对简便、精确,且可获取更多的血流动力学相关数据[18]。
在既往的研究中,若使用低温冷水浸泡法建模研究AH过程中的炎症反应及脏器损伤,将大鼠核心温度控制至在15℃较为适宜。在该温度下,各炎症指标变化较明显且大鼠生存率最高[12-13, 17]。以15℃低温冷水浸泡后,大鼠核心温度可逐渐下降并维持在16.5℃左右,该过程持续大约(137.42±21.86) min[11]。当核心温度低于20℃,大鼠血压开始下降,呼吸逐渐减弱。持续浸泡约5 h后,大鼠陷入深昏迷状态,对外界刺激没有反应,病死率可达20%以上[13]。巴马猪在降温过程中的代谢变化与人体相似。在此动物模型中,常选择将核心温度控制在27℃左右,因为该温度接近于人体维持自主循环的体温下限,同时属于重度AH范围[15-16]。停止降温后,巴马猪可能会有短暂的体温后降[14]。
2.3 人工气候箱法人工气候箱法常用于研究AH过程中炎症反应及氧化应激对各脏器的影响[19-23]。由于人工气候箱体积有限,该模型一般选用小鼠[24]或大鼠作为实验对象。急性冷暴露实验中,环境温度多被设置为-20 ℃[19, 22, 25],而慢性长期冷暴露则控制在4 ℃[20, 26]左右。值得一提的是,由于大鼠皮毛较厚,耐寒能力较强,即使在-20 ℃环境下,短时间内核心温度变化也并不明显。为了缩短造模时间,有研究者曾尝试刮除大鼠背部/腹部毛发,并将其浸泡在96%乙醇中约10 s,而后暴露于4 ℃低温环境中进行造模[27-28]。但该方法并未得到广泛认可。
在小鼠模型中,当核心温度达到20 ℃左右时,即可观察到多项病理生理改变,如肺组织结构紊乱、心脏炎症因子表达增加等,这一过程大约需要77 min,而核心温度下降至15 ℃则需83.67 min左右[19]。此后小鼠核心温度将断崖式下降,短时间内即可降至11~13 ℃并极易发生心脏骤停[22]。而以大鼠人工气候箱法构建AH模型,在环境温度的设置与达到相应核心温度的时间上还存在一定争议。在Takauji等[25]的研究中,-20℃环境中大鼠核心温度下降至26 ℃需要40 min;而同样设置-20℃环境,田孝野等[19]研究中小鼠核心温度下降至26 ℃尚需67 min左右。耐寒能力更出色的大鼠降温速度反而更快似乎并不合理。这些差异性结果可能与大鼠的种类、体重,以及实验中的其他环境条件设置如增加风冷降温环节等有关,相关文献中并未进行详细讨论,具体原因尚需进一步研究。
2.4 其他造模方式除上述造模方式以外,小部分研究采用冰袋/碎冰直接接触、掩埋,冷水淋浴或单纯平台降温等方式构建AH动物模型[29-30],但均未得到广泛认可。此外,还有部分动物模型用于研究冷水浸泡性低体温伴创伤救治,这类模型通常以特定方式诱导动物脏器损伤,而后浸入冷水,其步骤与上文描述基本一致。例如采用受控皮质撞击颅脑致伤法构建颅脑创伤模型后浸泡在18 ℃冷水中进行复合伤救治研究[31],或将聚乙烯导管置入大鼠右颈动脉进行失血性休克造模,然后浸泡在(23±1)℃的人工海水中进行特殊环境下的休克救治研究等[32]。
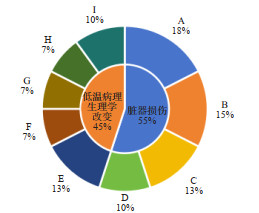
3 AH研究现状分析文章内容,AH相关动物研究目前主要集中在低温导致的脏器损伤以及低温复温过程中的相关病理生理改变(图 1)。其中脏器损伤研究以心、肺为主,肝脏[10, 20, 33]次之,多涉及炎症/氧化应激通路在AH过程中的变化。病理生理学改变则涉及广泛,体温后降现象[14]、药代动力学变化[34]、基因表达[28, 35-36]以及凝血功能[18, 22, 25]的异常等都有所报道。
|
| 注:A为肺损伤;B为心脏损伤;C为肝脏损伤;D为其他脏器损伤(脑、肾、腹直肌损伤);E为心脏机械功能变化;F为复温治疗;J为基因表达;H为凝血功能变化;I为其他病理生理改变(体温后降、药代动力学、器官血流及氧输送) 图 1 AH国内外研究现状 |
|
|
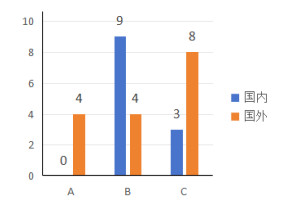
此外,国内外对于AH模型构建方式的选择亦有差异(图 2)。国内主要以冷水浸泡法建模以研究冷水浸泡性低体温所致肺损伤及相关炎症反应。国外则多选择进行肠内U型管降温,以便于研究AH过程中的心脏电/机械生理改变。气候箱法在国内外均有应用,但在多篇研究[19, 21, 36-37]中,其环境温度的设置自-20~10℃不等,且研究过程中实验动物的选择与预处理均有所不同,因此模型差异较大。
|
| 注:A为肠内U型管置入联合低温平台降温法;B为低温冷水浸泡法;C为人工气候箱法;肠内U型管置入联合低温平台降温法国内尚无文献报道,国内多使用低温冷水浸泡法 图 2 国内外对于AH模型构建方式选择 |
|
|
目前,多数AH模型需要对动物进行麻醉约束,这将降低动物应激、简化操作并使实验条件标准化。特别是针对需要复杂或精确操作的实验过程,非麻醉状态下的动物往往难以配合达到预期实验效果。但另一方面,麻醉可能对体温调控造成干扰,药物本身的性质也可能给研究带来干扰。此外,非麻醉状态下的动物模型在研究低温与神经系统相互关系、应激反应(如肌颤)、复温时能量代谢等方面通常更具优势[38-39]。
4 AH动物模型差异性比较总体而言,三种模型各有特点(表 1)。
| 模型构建方式 | 缺点 | 优点 |
| 肠内U型管置入联合平台降温法 | (1)有创性大,操作相对复杂; (2)建模过程中死亡风险高; (3)与自然条件下发生AH有一定差异性 |
(1)模型稳定; (2)核心温度数据准确; (3)便于监测心电/机械功能变化,数据获取便利 |
| 低温冷水浸泡法 | (1)多数监测设备(如心电、肺动脉导管等); (2)使用不方便; (3)血流动力学数据难以获取; (4)实验降温所用液体可能对实验结果有影响 |
(1)无创; (2)核心温度数据准确; (3)与自然环境下的AH贴合度高; (4)可进行单次长时程冷暴露研究 |
| 人工气候箱法 | (1)核心温度具有滞后性; (2)空间较小,精细化操作受限制; (3)难以获得更多数据; (4)测量肛温过程中环境温度改变 |
(1)无创; (2)操作最简易; (3)与自然环境下的AH贴合度高; (4)可控制温度进行慢性长期冷暴露 |
| 注:AH为意外性低体温 | ||
肠内U型管置入联合平台降温法可在室温下造模,操作空间更大,这使得部分仪器的连接和使用得以实现。特别是在心脏实时监测方面,如实时心律、心输出量、血流动力学等数据的获取更为便利。同时,由于采用肠内降温的缘故,该模型核心温度的监测多配合研究手段,采用食管下段测定、肺动脉测定或肝下置入温度传感器等方式进行,相对于传统的直肠内测温,其稳定性与准确性明显升高[40]。但另一方面,该造模方法较为复杂,对仪器设备的要求较高,U型管往往需要单独定制。期间还涉及多项有创操作,侵入性较大,实验动物发生肠穿孔等机械性损伤的风险增加,且与自然环境下发生的AH有一定差异。
而低温冷水浸泡模型为无创方案,同时可以较好的模拟海上遇难者发生AH的环境条件。由于水的导热系数较大,实验动物可以在相对低温下(4~15℃)迅速降温,且在浸泡过程中通常被视为周身同步降温。而因为环境温度的设置通常与目标体温相同,实验动物核心温度在达到设定值后常可在小范围内保持较长时间,这使得单次长时程冷暴露研究成为可能[12]。但需注意的是,由于除口鼻外,实验动物周身均浸泡在冷水中,建模时大多数仪器设备无法直接使用。此外,降温用液体(冷生理盐水或人工海水等)长时间接触大鼠皮肤也可能对实验结果产生直接影响,因此一般多用于模拟特殊环境(落水/海难)所致的AH研究。
相对于前者,人工气候箱法的应用范围明显更加广泛,这与模型构建的便捷性与无创性密切相关。它可以根据实验者的需求在较大范围内、迅速地改变环境温度,并长时间维持。这也是唯一应用于慢性长期冷暴露实验中的动物模型。此外,冷空气暴露下直接诱发的AH似乎也更加符合现实情况。该模型的主要缺点在于人工气候箱空间狭小,可操作范围不足,实验过程中一些较为精细化的操作难以进行。而由于低温下造模,大部分仪器无法持续工作,数据采集也相对困难。
除模型的差异之外,实验动物的选择也具有一定的区别。在入选的大多数文献中,啮齿类动物如大鼠、小鼠为实验首选,它们体型小、降温快、易获取,适用于多种实验器材,同时培育体系成熟,动物模型可重复性高。但自身体积小、重量轻,难以满足大量多次取血、连续血流动力学监测等高操作要求。而大型实验动物如巴马猪[41],其解剖学和生理代谢等方面与人类的相似度更高,相比大小鼠等实验动物有独特的优越性,但操作相对复杂,价格昂贵,难以大规模的应用。
5 AH模型的选择与实验终点设置实验模型构建方案的选择主要取决于研究目的,这一过程涉及实验终点的考量,包括环境温度与持续时间。
模型构建的环境温度和持续时间将直接影响动物的生理状态、各系统功能和脏器损伤严重程度[9]。部分研究者意图探索急性冷暴露过程中某一脏器的炎症/氧化应激反应,或是通过某种干预手段降低冷暴露的致死率或脏器损伤。研究通常会希望实验动物能在一段较长的时间范围内达到中度甚至重度低体温,或在该体温下维持较长的时间,以便提高实验阳性率,但为了保证实验的稳定性和可重复性,时间又不宜过长,因此在前期往往花费大量精力进行探索。
另一方面,由于低温本身的特异性(轻度低温会抑制炎症反应,重度将严重影响代谢功能,甚至造成“假死”表现),建模过程中很难通过常规手段,如某些行为学或病理生理学改变来判断实验动物是否真正死亡或出现预期结果。因此,研究者通常将实验动物核心温度作为实验终点而不是时间或病死率。但这并非绝对,例如在一些报道中,研究目的为慢性长期冷暴露后的肺部炎症改变,此时实验终点仅考虑每日冷暴露的时间,模型选择上则更加偏向于无创、便捷的方案,因此多使用气候箱法[20, 26]。而部分AH过程中心律失常的研究则考虑更多的是建模过程中心电监测与血流动力学设备的使用,此时选择肠内U型管造模则更为合理。既往部分研究的实验目的与实验终点设置[6, 11, 13, 19-20, 25-26, 35]如表 2所示。
| 模型构建方法 | 动物选择 | 研究目的 | 实验终点设置 | |
| 环境温度(℃) | 持续时间 | |||
| 肠内U型管置入联合平台降温法 | Wistar大鼠 | 急性冷暴露 | 0~4 | 核心温度降至15℃保持3~4 h |
| 低温冷水浸泡法 | SD大鼠 | 急性冷暴露 | 15 | 浸泡5 h |
| SD大鼠 | 单次长时程 | 18~20 | 浸泡24 h | |
| 人工气候箱法 | Wista大鼠 | 急性冷暴露 | -20 | 核心温度降至26℃ |
| Wistar大鼠 | 急性冷暴露 | 4 | 核心温度降至12℃ | |
| C57BL/6小鼠 | 急性冷暴露 | -20 | 核心温度降至10℃ | |
| SD大鼠 | 慢性长期冷暴露 | 4 | 每日4 h,持续21 d | |
| C57BL/6小鼠 | 慢性冷暴露 | 4 | 21 d | |
AH的发生发展过程涉及多系统、多脏器功能异常,但具体机制并不清楚。根据研究目标的不同,选择适当的方案构建便捷稳定、可重复性高的动物模型,对进行AH的发展、治疗及预后的研究具有重要意义。
在以上的讨论中,笔者叙述了许多关于AH动物模型构建方法的研究进展,但实际上,由于研究的独立性以及科研方向的差异,各类方案之间缺少标准化架构下的横向比较,同一条件下孰优孰劣难以评定。例如在模型选择方面,三种造模方案均可模拟急性冷暴露条件下的心脏损伤,但各自造成的损伤程度与时间成本并不明确;而在其他方面,呼吸机辅助通气是否会引起肠内U型管置入大鼠模型的气道复温?肝下置入温度传感器是否会导致实验动物的炎症或自主排斥反应而干扰实验结果?这些仍需要进行进一步探索。
利益冲突 所有作者声明无利益冲突
| [1] | Jin HX, Teng Y, Dai J, et al. Expert consensus on the prevention, diagnosis and treatment of cold injury in China, 2020[J]. Mil Med Res, 2021, 8(1): 6. DOI:10.1186/s40779-020-00295-z |
| [2] | Wiberg S, Mortensen AF, Kjaergaard J, et al. Accidental hypothermia in Denmark: a nationwide cohort study of incidence and outcomes[J]. BMJ Open, 2021, 11(5): e046806. DOI:10.1136/bmjopen-2020-046806 |
| [3] | Dietrichs ES, Selli AL, Kondratiev T, et al. Resistance to ventricular fibrillation predicted by the QRS/QTc - Ratio in an intact rat model of hypothermia/rewarming[J]. Cryobiology, 2021, 98: 33-38. DOI:10.1016/j.cryobiol.2021.01.003 |
| [4] | Nilsen JH, Schanche T, Kondratiev TV, et al. Maintaining intravenous volume mitigates hypothermia-induced myocardial dysfunction and accumulation of intracellular Ca2[J]. Exp Physiol, 2021, 106(5): 1196-1207. DOI:10.1113/EP089397 |
| [5] | Håheim B, Kondratiev T, Dietrichs ES, et al. The beneficial hemodynamic effects of afterload reduction by sodium nitroprusside during rewarming from experimental hypothermia[J]. Cryobiology, 2017, 77: 75-81. DOI:10.1016/j.cryobiol.2017.05.002 |
| [6] | Tveita T, Arteaga GM, Han YS, et al. Cardiac troponin-I phosphorylation underlies myocardial contractile dysfunction induced by hypothermia rewarming[J]. Am J Physiol Heart Circ Physiol, 2019, 317(4): H726-H731. DOI:10.1152/ajpheart.00101.2019 |
| [7] | Dietrichs ES, Håheim B, Kondratiev T, et al. Effects of hypothermia and rewarming on cardiovascular autonomic control in vivo[J]. J Appl Physiol (1985), 2018, 124(4): 850-859. DOI:10.1152/japplphysiol.00317.2017 |
| [8] | Saczkowski R, Kuzak N, Grunau B, et al. Extracorporeal life support rewarming rate is associated with survival with good neurological outcome in accidental hypothermia[J]. Eur J Cardiothorac Surg, 2021, 59(3): 593-600. DOI:10.1093/ejcts/ezaa385 |
| [9] | 徐耀迪, 王佳新, 陈旭昕, 等. 冷诱导RNA结合蛋白在大鼠低体温性急性肺损伤中的表达变化[J]. 解放军医学院学报, 2023, 44(4): 380-387. |
| [10] | 王军辉, 王宏伟, 张海欧. 体温过低大鼠复温过程中肝功能指标的变化规律及意义[J]. 山东医药, 2013, 53(1): 33-34. DOI:10.3969/j.issn.1002-266X.2013.01.011 |
| [11] | 乔媛媛, 熊鸣, 马伟, 等. 参附注射液对海水浸泡性体温过低症大鼠的保护作用[J]. 中国急救复苏与灾害医学杂志, 2022, 17(2): 234-238. |
| [12] | 奂剑波. 温水浴复温对长时程海水浸泡体温过低症SD大鼠肺损伤及血清酶学影响的研究[D]. 上海: 中国人民解放军海军军医大学, 2018. |
| [13] | 陈丽娜. 两种复温方法对急性重度海水浸泡性体温过低症大鼠肺损伤氧化应激和炎症因子的影响[D]. 合肥: 安徽医科大学, 2018. |
| [14] | 刘书林, 曹文, 姚永杰, 等. 小型猪模拟海水浸泡冻僵后给予不同复温方法的体温后降效应观察[J]. 空军医学杂志, 2021, 37(5): 374-378. |
| [15] | Filseth OM, How OJ, Kondratiev T, et al. Post-hypothermic cardiac left ventricular systolic dysfunction after rewarming in an intact pig model[J]. Crit Care, 2010, 14(6): R211. DOI:10.1186/cc9334 |
| [16] | Valkov S, Mohyuddin R, Nilsen JH, et al. Organ blood flow and O2 transport during hypothermia (27℃) and rewarming in a pig model[J]. Exp Physiol, 2019, 104(1): 50-60. DOI:10.1113/EP087205 |
| [17] | 程浩, 奂剑波, 陈丽娜, 等. 长时程海水浸泡体温过低大鼠的病理学和血液学观察[J]. 中华航海医学与高气压医学杂志, 2018, 25(5): 281-288. DOI:10.3760/cma.j.issn.1009-6906.2018.05.002 |
| [18] | Schanche T, Filseth OM, Østerud B, et al. Enhanced blood clotting after rewarming from experimental hypothermia in an intact porcine model[J]. Front Physiol, 2022, 13: 901908. DOI:10.3389/fphys.2022.901908 |
| [19] | 田孝野, 刘颖, 王卓君, 等. 低温致急性全身性冷损伤小鼠动物模型建立[J]. 中华急诊医学杂志, 2023, 32(4): 521-526. DOI:10.3760/cma.j.issn.1671-0282.2023.04.014 |
| [20] | 王基野, 黄冠鹏, 陈迎雷, 等. 线粒体融合蛋白在4℃间歇性冷暴露保护肝脏冷损伤中的作用研究[J]. 解放军预防医学杂志, 2020, 38(7): 1-5. DOI:10.13704/j.cnki.jyyx.2020.07.001 |
| [21] | 张莹, 李曦, 张莉, 等. 急性冷暴露对大鼠肺组织中促炎性因子表达的影响[J]. 中国应用生理学杂志, 2015, 31(1) 6-9, 98. DOI:10.13459/j.cnki.cjap.2015.01.002 |
| [22] | Horioka K, Tanaka H, Isozaki S, et al. Rewarming from accidental hypothermia enhances whole blood clotting properties in a murine model[J]. Thromb Res, 2020, 195: 114-119. DOI:10.1016/j.thromres.2020.07.022 |
| [23] | 张博熙, 金壬顺, 吕红明, 等. 急性冷暴露促进C57BL6幼鼠海马体细胞凋亡[J]. 黑龙江八一农垦大学学报, 2023, 35(2) 47-52, 66. |
| [24] | 曹滨验, 戴晶, 游平飞, 等. 原花青素对低体温致小鼠急性肺损伤的保护作用及机制研究[J]. 创伤与急危重病医学, 2024, 12(5): 267-271. DOI:10.16048/j.issn.2095-5561.2024.05.03 |
| [25] | Takauji S, Tanaka H, Hayakawa M, et al. Soluble thrombomodulin ameliorates aberrant hemostasis after rewarming in a rat accidental hypothermia model[J]. Biochem Biophys Res Commun, 2022, 587: 1-8. DOI:10.1016/j.bbrc.2021.11.086 |
| [26] | Xu B, Lang LM, Lian S, et al. Oxidation stress-mediated MAPK signaling pathway activation induces neuronal loss in the CA1 and CA3 regions of the hippocampus of mice following chronic cold exposure[J]. Brain Sci, 2019, 9(10): 273. DOI:10.3390/brainsci9100273 |
| [27] | Umehara T, Usumoto Y, Tsuji A, et al. Expression of material mRNA in the hypothalamus and frontal cortex in a rat model of fatal hypothermia[J]. Leg Med, 2011, 13(4): 165-170. DOI:10.1016/j.legalmed.2011.01.005 |
| [28] | Umehara T, Mori R, Murase T, et al. Rno-miR-203a-3p and Mex3B contribute to cell survival of iliopsoas muscle via the Socs3-Casp3 axis under severe hypothermia in rats[J]. Leg Med (Tokyo), 2022, 59: 102150. DOI:10.1016/j.legalmed.2022.102150 |
| [29] | Burggraf M, Lendemans S, Waack IN, et al. Slow as compared to rapid rewarming after mild hypothermia improves survival in experimental shock[J]. J Surg Res, 2019, 236: 300-310. DOI:10.1016/j.jss.2018.11.057 |
| [30] | Strapazzon G, Putzer G, Dal Cappello T, et al. Effects of hypothermia, hypoxia, and hypercapnia on brain oxygenation and hemodynamic parameters during simulated avalanche burial: a porcine study[J]. J Appl Physiol (1985), 2021, 130(1): 237-244. DOI:10.1152/japplphysiol.00498.2020 |
| [31] | 张灏, 叶丹, 潘振洪, 等. 二氢杨梅素对创伤性脑损伤合并海水浸泡性体温过低症大鼠脑损伤的作用机制[J]. 医学研究与战创伤救治, 2024, 37(7): 704-708. DOI:10.16571/j.cnki.2097-2768.2024.07.006 |
| [32] | Wang LL, Tian YM, Hu S, et al. Study on an animal model of seawater immersion injury following hemorrhagic shock[J]. J Surg Res, 2023, 287: 24-32. DOI:10.1016/j.jss.2023.01.012 |
| [33] | 林楠, 蔡志聪, 吴伟航, 等. 保温救生衣对低温海水浸泡犬的保护作用研究[J]. 医学研究杂志, 2018, 47(11): 92-95. DOI:10.11969/j.issn.1673-548X.2018.11.021 |
| [34] | 王强, 冯博, 张沂, 等. 伏立康唑在海水浸泡致低体温家兔体内的药代动力学变化研究[J]. 转化医学杂志, 2014, 3(4): 216-219. DOI:10.3969/j.issn.2095-3097.2014.04.007 |
| [35] | Umehara T, Murase T, Abe Y, et al. Identification of potential markers of fatal hypothermia by a body temperature-dependent gene expression assay[J]. Int J Legal Med, 2019, 133(2): 335-345. DOI:10.1007/s00414-018-1888-3 |
| [36] | Kaija H, Pakanen L, Kortelainen ML, et al. Hypothermia and rewarming induce gene expression and multiplication of cells in healthy rat prostate tissue[J]. PLoS One, 2015, 10(5): e0127854. DOI:10.1371/journal.pone.0127854 |
| [37] | Kaija H, Pakanen L, Uusitalo J, et al. Changes in cardiac thrombomodulin and heat shock transcription factor 1 expression and peripheral thrombomodulin and catecholamines during hypothermia in rats[J]. Stress, 2014, 17(6): 504-511. DOI:10.3109/10253890.2014.953477 |
| [38] | 奂剑波, 陈丽娜, 史成和, 等. 麻醉对大鼠海水浸泡体温过低症模型的影响[J]. 转化医学杂志, 2018, 7(1) 45-48, 53. DOI:10.3969/j.issn.2095-3097.2018.01.012 |
| [39] | 林仁钊, 陈强, 朱洪辰, 等. 实验动物全身麻醉方法及用药研究进展[J]. 广东畜牧兽医科技, 2024, 49(6): 104-108. DOI:10.19978/j.cnki.xmsy.2024.06.17 |
| [40] | Strapazzon G, Procter E, Paal P, et al. Pre-hospital core temperature measurement in accidental and therapeutic hypothermia[J]. High Alt Med Biol, 2014, 15(2): 104-111. DOI:10.1089/ham.2014.1008 |
| [41] | 邹迪莎, 于健. 巴马小型猪动物模型在医学领域的研究进展[J]. 中国畜牧兽医, 2017, 44(4): 1128-1134. DOI:10.16431/j.cnki.1671-7236.2017.04.027 |
 2025, Vol. 34
2025, Vol. 34