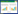2. 海南医科大学附属海南医院(海南省人民医院)乳腺外科, 海口 570311
Bauersfeld于1947年首次报道了肠系膜上动脉夹层[1],男女发病比例约5∶1,平均年龄55岁左右[2]。肠系膜上动脉(superior mesenteric artery, SMA)夹层出血的发病机制,目前仍无统一的定论。可能与囊性中膜退变、肌纤维发育不良、动脉粥样硬化、外伤等因素有关[3],也可能是与受血流冲击处血管的凸面曲率大小有关[4]。对于未出现肠缺血、坏死的病例经保守治疗的报道较多[5]。但对于发展至中期或晚期阶段,已经发生肠坏死的肠系膜静脉血栓形成必须开腹手术治疗,手术治疗的目的是切除坏死的小肠,减少毒素的吸收[6]。开腹手术包括动脉瘤缝闭、自体动脉或静脉搭桥、取栓、内膜瓣固定等方法,也有将开放性手术与血管内植入支架联合进行治疗的报道[7-12]。外科手术创伤大、难度大、风险高。本病例尝试于SMA主干植入覆膜支架治疗SMA主干出血, 虽然在支架植入过程中出现了急性血栓形成及术后胃肠动力减弱等较为棘手的问题,最终仍然取得了较好的治疗效果。
1 病例资料患者女,78岁,无明显诱因出现上腹部剧烈疼痛2 d入院,呈持续性,伴有恶心呕吐胃内容物数次、大汗淋漓、面色苍白、烦躁,否认既往高血压病史。查体:腹部叩诊呈鼓音,腹肌稍紧,全腹可及压痛,反跳痛(+/-),移动性浊音(+/-),肠鸣音弱。急诊查腹部CT示中腹部腹膜后血肿(图 1),考虑肠系膜动脉破裂可能,血肿大小约8.0 cm×4.6 cm,血红蛋白84 g/L,血压146/81 mmHg(1 mmHg=0.133 kPa)。外科专家会诊认为开腹治疗难度大,风险高,且患者及家属心理压力大,拒绝开腹手术。腹痛自行稍好转即出院。1周后患者活动时再次出现突发疼痛,症状与1周前相同。返回急诊科,经高风险谈话后接受了微创血管腔内治疗。
|
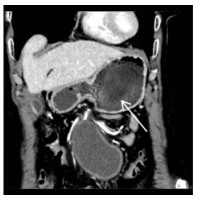
| 图 1 CTA发现腹腔巨大血肿,伴有瘤腔内对比剂强化(箭头示) |
|
|
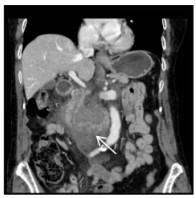
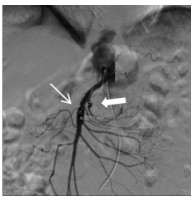
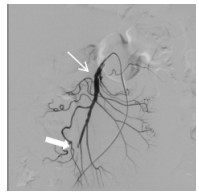
消毒右侧腹股沟区,经右侧股动脉入路。经穿刺点置入5F血管鞘,0.035 -in导丝引导5F Cobra导管进入SMA近端,造影(造影剂速度4~6 mL/s,时间3~4 s),明确病变位置及肠系膜远端血供情况。造影可见SMA近端呈夹层样改变(图 2细箭头示),空肠动脉分支近端呈假性动脉瘤样改变(图 2粗箭头示),虽然有夹层出现,但SMA主干全程尚通畅。更换8F血管鞘,应用导管导丝技术送入肝素涂层血管内覆膜支架(7 mm×25 mm)覆盖于夹层段并造影,发现病变段未完全封闭(图 3细箭头示)。主要由于为尽量减少支架对远端正常分支血管的影响,第一枚支架长度略短,因此再植入一枚支架(8 mm×25 mm)与第一枚叠加。再次经SMA造影,发现SMA主干内对比剂滞留(图 4),SMA中主干远端及其分支血管未显影。同时患者出现腹痛加重、气促、心率减慢至约40~50次/min,血压高压达到180/100 mmHg,考虑患者发生急性动脉血栓形成。紧急予面罩吸氧,静脉注射阿托品肌0.5 mg。经导管于SMA应用尿激酶25万U、肝素3 000 U进行持续灌注,灌注时间约5~8 min。应用球囊(8 mm×50 mm)扩张支架。最后再次经SMA造影,可见SMA主干近端再通,夹层瓣膜及其附近病变空回肠血管未再显影。病变远端空回肠动脉分支大部分恢复通畅(图 5粗箭头示),但SMA主干远端部分血管仍有部分未溶解血栓(图 5细箭头示),术后回病房每天皮下注射低分子肝素钙2 500单位,2次/d;患者腹痛症状当即减轻,生命体征恢复正常。
|
| 图 2 造影可见SMA主干内夹层(细箭头示),夹层附近空回肠动脉近端瘤样扩张(粗箭头示) |
|
|
|
| 图 3 病变段植入第一枚支架后,夹层消失(粗箭头示),但空回肠动脉近端动脉瘤未完全覆盖,且SMA远端血管血栓形成(细箭头示) |
|
|
|
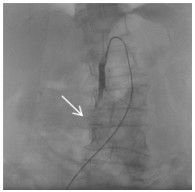
| 图 4 SMA近端植入第二枚支架后,对比剂滞留,主干内血栓形成,分支血管被截断 |
|
|
|
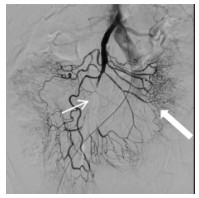
| 图 5 紧急经导管注入肝素、尿激酶后,大部分分支血管恢复开通(粗箭头示) |
|
|
患者行支架植入后第二天即出现进食后呕吐,肠鸣音减弱,即便进流食同样呕吐。可能与覆膜支架阻碍了SMA近段空回肠动脉的血流导致胃肠动力障碍,胃潴留(图 6)。患者肠鸣音可闻及,有排气,推测未出现肠缺血坏死。为了增强营养支持治疗,给予患者经鼻腔植入空回肠营养管,并将其远端通过十二指肠送入空肠(图 7)。留置营养管出院,院外口服利伐沙班片25 mg 1次/d。1个月后患者循序渐进尝试经口进流食,未出现呕吐,遂拔除营养管,2个月后恢复普通饮食,随访至半年未再出现腹痛症状。
|
| 图 6 术后患者出现胃潴留(细箭头示),进食后呕吐 |
|
|
|
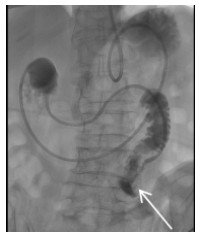
| 图 7 经鼻植入营养管,远端进入空肠(箭头示) |
|
|
查阅文献,极少见到非开腹条件下植入覆膜支架治疗SMA主干出血的报道,可能原因包括:(1) SMA主干夹层可导致管腔闭塞,血栓形成[13]。患者可能在就诊时已经出现肠缺血坏死,需要及时剖腹探查,必要时可及时切除部分坏死肠管,减少死亡概率。(2) 已发生动脉出血患者不适合肝素化抗凝治疗,这为血管腔内植入支架及球囊扩张带来急性血栓形成的风险。(3) 在技术操作上可能存在困难:SMA主干出血多继发于夹层病变,夹层瓣膜可能会压迫真腔,导致导丝无法进入真腔,从而无法进行后续操作;另外覆膜支架质地僵硬,SMA与主动脉呈锐角,可能阻碍支架顺利植入。(4)覆膜支架会阻断SMA分支血管,可能导致肠缺血坏死[5]。
本病例能在非开腹条件下完成治疗是需要前提条件的。首先需要判断肠管有无缺血坏死,否则耽误外科处理时间,失去挽救机会将得不偿失。本病例肠鸣音基本正常,腹膜刺激征未表现为强阳性;其次通过CTA显示SMA主干及其分支显影较好,且并未发现管腔积气积液等肠坏死所导致的征象,可以大概判断患者尚未出现肠管坏死。这为腔内介入治疗提供了可能。
在血管内植入支架之前通常需要常规全身肝素化以减少、避免血栓形成,是业界共识。但本病例因血管已经出现破裂出血,腹腔大血肿。为了避免出血增多术前未进行全身肝素化,这是导致此项操作风险极高的另一主要因素。在未肝素化的条件下,支架输送至SMA主干时,管腔内血液流量减少,流速降低,在覆膜支架释放展开的过程中,血流甚至会被完全阻断;此外植入的支架及损伤的血管内皮均属于外源性凝血因素,所以支架释放后管腔内急性血栓形成属于情理之中。即便所使用支架具备肝素涂层,仍然无法阻止血栓形成。在紧急使用尿激酶经SMA灌注后,管腔可以实现大部分开通,远端分支若干血管尚存血栓。经术后肝素抗凝治疗,可继续恢复部分管腔通畅。
SMA夹层病变血管真腔一般偏小,血流偏快,假腔通常偏大,血流偏慢,术前要评估在有夹层的管腔里能否顺利将导丝送入真腔。CT是诊断及后续辅助治疗SMA夹层的重要手段[14]。通过CTA可以大概了解SMA夹层段假腔是否完全压迫真腔,有助于增加导丝顺利进入真腔的概率。另外,通过CTA观察SMA与腹主动脉的成角。覆膜支架硬度高,不易弯曲,如果角度过小,经股动脉入路无法送入支架进入SMA,可能需改行经肱动脉由上向下植入。
国内应用支架植入治疗的报道多为出现夹层但未发生管腔破裂出血的病例,均应用或提倡裸支架[15-16],目的是避免SMA分支血管缺血导致肠缺血坏死。然而裸支架无法阻止MSA出血。本病例应用覆膜支架存在可能性的原因在于:基于肠道的血供主要来自肠系膜上动脉、肠系膜下动脉和腹腔动脉系统的侧支循环的解剖学基础,它们之间通过侧支循环相互连接,少数血管的损坏不一定会导致肠道缺血坏死;本病例出血病变的SMA主干血管长度较短约2 cm,阻断少量的空回肠动脉分支不一定会导致大面积肠管缺血;术后患者出现胃肠动力下降、胃潴留,进食后呕吐,可能与肠管缺血有关。
随着介入放射学的飞速发展,胃肠营养管的出现已经突破了传统鼻饲管的应用局限性,可以越过幽门、十二指肠进入空肠,应用广泛。在留置舒适性、术后营养恢复效率中具有独特优势[17],这为肠系膜植入覆膜支架后肠动力减弱的治疗提供了有力支持。
腔内支架技术治疗肠系膜上动脉夹层伴破裂出血虽然是个例,但此方法能够引发一些思考:(1)SMA主干可以承受多长的覆膜支架?如果增加支架长度,是否可引起肠动力无法恢复甚至肠坏死?(2)如果在输送支架前,于SMA起始部持续少量注入肝素或全身肝素化也许能够避免急性血栓形成?这些问题仍有待进一步研究。
利益冲突 所有作者声明无利益冲突
| [1] | Casella IB, Bosch MA, Sousa WO Jr. Isolated spontaneous dissection of the superior mesenteric artery treated by percutaneous stent placement: case report[J]. J Vasc Surg, 2008, 47(1): 197-200. DOI:10.1016/j.jvs.2007.07.051 |
| [2] | Wu XM, Wang TD, Chen MF. Percutaneous endovascular treatment for isolated spontaneous superior mesenteric artery dissection: report of two cases and literature review[J]. Catheter Cardiovasc Interv, 2009, 73(2): 145-151. DOI:10.1002/ccd.21806 |
| [3] | Krupski WC, Effeney DJ, Ehrenfeld WK. Spontaneous dissection of the superior mesenteric artery[J]. J Vasc Surg, 1985, 2(5): 731-734. DOI:10.1067/mva.1985.avs0020731 |
| [4] | Park YJ, Park CW, Park KB, et al. Inference from clinical and fluid dynamic studies about underlying cause of spontaneous isolated superior mesenteric artery dissection[J]. J Vasc Surg, 2011, 53(1): 80-86. DOI:10.1016/j.jvs.2010.07.055 |
| [5] | 杨进, 沈来根, 刘震杰, 等. 急性孤立性肠系膜上动脉夹层的诊治[J]. 中华急诊医学杂志, 2012, 21(5): 545-547. DOI:10.3760/cma.j.issn.1671-0282.2012.05.027 |
| [6] | 孙云川, 徐福芹, 郭书芹, 等. 急性肠系膜静脉血栓形成的诊断与治疗[J]. 中华急诊医学杂志, 2006, 15(9): 834-836. DOI:10.3760/j.issn:1671-0282.2006.09.019 |
| [7] | 满家豪, 唐博. 孤立性肠系膜上动脉夹层的腔内治疗进展[J]. 中国普外基础与临床杂志, 2024, 31(9): 1147-1152. |
| [8] | Picquet J, Abilez O, Pénard J, et al. Superficial femoral artery transposition repair for isolated superior mesenteric artery dissection[J]. J Vasc Surg, 2005, 42(4): 788-791. DOI:10.1016/j.jvs.2005.05.048 |
| [9] | 李孝成, 刘佳. 自发性孤立性肠系膜上动脉夹层的治疗现状[J]. 海南医学, 2022, 33(7): 935-938. DOI:10.3969/j.issn.1003-6350.2022.07.030 |
| [10] | Zhou Y, Ryer EJ, Garvin RP, et al. Outcomes of endovascular treatments for in-stent restenosis in patients with mesenteric atherosclerotic disease[J]. J Vasc Surg, 2019, 69(3): 833-842. DOI:10.1016/j.jvs.2018.08.166 |
| [11] | 中国医师协会介入医师分会外周血管介入专业委员会. 孤立性肠系膜上动脉夹层诊治专家共识[J]. 中华放射学杂志, 2021, 55(4): 352-358. DOI:10.3760/cma.j.cn112149-20200506-00649 |
| [12] | Nomura Y, Yamaguchi M, Kitagawa A, et al. Hybrid management of ruptured isolated superior mesenteric artery dissecting aneurysm[J]. J Vasc Surg, 2011, 54(6): 1808-1811. DOI:10.1016/j.jvs.2011.05.006 |
| [13] | 厉永伟, 张玲晓. 急性肠系膜血管栓塞二例[J]. 中华急诊医学杂志, 2001, 10(1): 67. DOI:10.3760/j.issn:1671-0282.2001.01.043 |
| [14] | 张萍, 赵雪, 吴静. 自发性孤立性肠系膜上动脉夹层患者的临床特点、MSCT征象及预后分析[J]. 中国CT和MRI杂志, 2024, 22(4): 144-146. |
| [15] | 韩道正, 沈超, 周云, 等. 自发性孤立性肠系膜上动脉夹层16例临床诊治分析[J]. 血管与腔内血管外科杂志, 2019, 5(2) 109-112, 129. DOI:10.19418/j.cnki.issn2096-0646.2019.02.004 |
| [16] | 李南, 陆清声, 景在平. 腔内支架技术治疗自发性孤立性肠系膜上动脉夹层[J]. 中国微创外科杂志, 2014, 14(1) 58-59, 68. |
| [17] | Blakely AM, Ajmal S, Sargent RE, et al. Critical analysis of feeding jejunostomy following resection of upper gastrointestinal malignancies[J]. World J Gastrointest Surg, 2017, 9(2): 53-60. DOI:10.4240/wjgs.v9.i2.53 |
 2025, Vol. 34
2025, Vol. 34