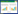急性心力衰竭(acute heart failure, AHF)是指继发于心脏功能异常而迅速发生或恶化的症状和体征并伴有血浆利钠肽水平的升高,既可以是急性起病,也可以表现为慢性心力衰竭急性失代偿(acute decompensated heart failure, ADHF)。AHF预后很差,住院病死率为3%,6个月的再住院率约50%,5年病死率高达60%[1]。AHF是临床上常见急症,常危及生命,必须快速诊断和紧急抢救治疗。为了降低疾病病死率,探索疾病早期诊断相关指标及预测预后指标至关重要。中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差(central venous-arterial carbon dioxide partial pressure difference/arterial-central venous oxygen content difference, Pv-aCO2/Ca-vO2)作为识别无氧代谢的指标近年来受到广泛关注[2]。且其水平的增高与脓毒性休克患者病死率增加及器官功能障碍严重程度明显相关[3]。但是Pv-aCO2/Ca-vO2在AHF合并组织低灌注中的研究不多。本研究选取中老年AHF合并组织低灌注患者,进一步探讨早期Pv-aCO2/Ca-vO2联合外周灌注指数(peripheral perfusion index, PI)对患者28 d预后的预测价值。
1 资料与方法 1.1 研究对象采用病例对照研究方法,收集2022年5月至2024年5月南京市第一医院急诊监护室收治的中老年AHF合并组织低灌注患者为研究对象。
纳入标准:(1)按照2022年中华医学会急诊医学分会《急性心力衰竭中国急诊管理指南》,符合AHF合并组织低灌注诊断标准[乳酸>2 mmol/L,同时合并四肢湿冷、少尿(尿量<0.5 mL/(kg·h))、意识状态改变中的一项或一项以上];(2)年龄>50岁;(3)住院时间超过24 h;(4)临床资料无缺失。排除标准:(1)既往有明确血液疾病或肿瘤病史;(2)长期使用免疫抑制剂和激素;(3)存在外周灌注指数监测禁忌如指端涂有颜料或严重色素沉着;(4)家属放弃进一步治疗。
根据28 d预后将患者分为存活组和死亡组。
本研究方案经南京市第一医院伦理委员会批准(审批号:KY20230829-03)。
1.2 血气分析指标及计算方法所有患者均留置中心静脉导管及建立动脉管路,通过中心静脉置管(颈内静脉或者锁骨下静脉)留取中心静脉血,采用cobas b 123血气分析仪(罗氏公司、德国)行血气分析测中心静脉血二氧化碳分压、中心静脉血氧分压及中心静脉血氧饱和度(central venous oxygen saturation, ScvO2),同时通过动脉管路留取血液行血气分析测动脉血二氧化碳分压、动脉血氧分压及动脉血氧饱和度,依据Fick公式计算动脉血氧含量、静脉血氧含量以及Pv-aCO2/Ca-vO2。
1.3 观察指标记录患者一般资料,如性别、年龄,基础心脏疾病;同时收集入院24 h内急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)-Ⅱ评分、血乳酸(lactate, Lac)和实验室生化指标[N末端B型钠尿肽前体(characteristics, N-terminal B-type natriuretic peptide precursor, NT-proBNP)、肌酸激酶(creatine kinase, CK)、肌酸激酶同工酶(creatine kinase-myocardial band, CK-MB)及心肌肌钙蛋白I(cardiac troponin I, TNI)数值、中心静脉压(central venous pressure, CVP)、左室射血分数(left ventricular ejection fraction, LVEF)]。
1.4 PI监测采用BeneVision N17迈瑞监护设备(深圳迈瑞生物医疗电子股份有限公司, 广东)上的传统脉氧监护仪进行测定,测量前确保血氧指套部位合适,避免指端涂有颜料(指甲油等),测量部位均统一选用中指,无传感器松动或接触不良,测量时未使用血管活性药物,室温在24~26℃。PI可根据脉氧波形计算获得,在监护仪上直接开通PI监测功能,进而读取并记录其数值。
1.5 统计学方法使用SPSS 26.0软件分析数据,正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用成组t检验; 分类变量以例(%)表示,组间比较用卡方检验。使用GraphPad Prism 9.0软件绘制受试者工作特征(receiver operator characteristic curve, ROC)曲线,计算ROC曲线下面积(AUC),评估PI、Pv-aCO2/Ca-vO2、PI联合Pv-aCO2/Ca-vO2对患者预后的预测价值。采用最佳截断值进行亚组分析,用Log-rank检验进行生存分析,并绘制Kaplan-Meier生存曲线。以P<0.05为差异有统计学意义。
2 结果 2.1 两组基线资料比较共纳入70例AHF伴组织低灌注患者,男性40例,女性30例;年龄(73.14±9.46)岁;28 d存活34例,死亡36例,28 d病死率为51.43%。两组间性别、年龄、基础疾病情况差异均无统计学意义(均P>0.05)。见表 1。
| 指标 | 存活组(n=34) | 死亡组(n=36) | χ2/t值 | P值 |
| 一般情况 | ||||
| 年龄(岁)a | 71.65±10.46 | 74.56±8.30 | 1.292 | 0.201 |
| 男性b | 19(55.9) | 21(58.3) | 0.043 | 0.836 |
| 基础疾病b | ||||
| 高血压心脏病 | 7(20.6) | 14(38.9) | 2.789 | 0.095 |
| 冠心病 | 17(50.0) | 14(38.9) | 0.875 | 0.350 |
| 扩张型心肌病 | 10(29.4) | 8(22.2) | 0.473 | 0.492 |
| 注:a为x±s,b为(例,%) | ||||
两组患者NT-proBNP、CK、CK-MB、TNI、CVP、LVEF指标差异无统计学意义(均P>0.05)。与存活组比较,死亡组患者APACHEⅡ、Lac、Pv-aCO2/Ca-vO2指标较高、PI指标较低,差异均具有统计学意义(均P<0.05)。见表 2。
| 指标 | 存活组(n=34) | 死亡组(n=36) | t值 | P值 |
| NT-proBNP(pg/mL) | 6 886.53±1 941.41 | 7 518.08±2 951.85 | 1.063 | 0.292 |
| CK(U/L) | 103.03±35.54 | 109.97±29.47 | 0.892 | 0.376 |
| CK-MB(U/L) | 22.85±3.61 | 25.21±6.76 | 1.835 | 0.072 |
| TNI(ng/mL) | 0.46±0.23 | 0.56±0.26 | 1.584 | 0.118 |
| CVP(cmH2O) | 13.11±2.16 | 14.30±4.73 | 1.361 | 0.180 |
| PI | 1.24±0.20 | 0.99±0.23 | 4.944 | <0.001 |
| APACHE Ⅱ(分) | 16.06±1.76 | 22.58±5.17 | 7.143 | <0.001 |
| LVEF(%) | 35.82±7.00 | 37.11±8.90 | 0.670 | 0.505 |
| Lac(mmol/L) | 2.41±0.21 | 2.99±0.59 | 5.496 | <0.001 |
| Pv-aCO2/Ca-vO2 | 1.51±0.12 | 1.66±0.09 | 6.090 | <0.001 |
| 注:NT-proBNP为N末端B型钠尿肽前体,CK为肌酸激酶,CK-MB肌酸激酶同工酶,TNI为心肌肌钙蛋白I,CVP为中心静脉压,PI为外周灌注指数,APACHEⅡ为急性生理学与慢性健康状况评分Ⅱ,LVEF为左室射血分数,Lac为血乳酸,Pv-aCO2/Ca-vO2为静脉-动脉血二氧化碳分压差与动脉-静脉血氧含量差比值;1 cmH2O=0.098 kPa | ||||
AUC由低至高依次为:外周灌注指数、Pv-aCO2/Ca-vO2、两者联合;联合指标预测AHF合并低灌注患者28 d预后的AUC明显高于单一指标(P<0.05);敏感度由低至高依次为:Pv-aCO2/Ca-vO2、外周灌注指数及两者联合;特异度由低至高依次为:外周灌注指数、Pv-aCO2/Ca-vO2、两者联合。见表 3、图 1。
| 指标 | AUC | 95%CI | P值 | 最佳截断值 | 敏感度(%) | 特异度(%) |
| PI | 0.804a | 0.701~0.908 | <0.001 | 1.17 | 83.3 | 67.6 |
| Pv-aCO2/Ca-vO2 | 0.848a | 0.758~0.938 | <0.001 | 1.59 | 77.8 | 79.4 |
| 联合指标 | 0.922 | 0.859~0.985 | <0.001 | - | 83.3 | 91.2 |
| 注:PI为外周灌注指数,Pv-aCO2/Ca-vO2为静脉-动脉血二氧化碳分压差与动脉-静脉血氧含量差比值;与联合指标比较,aP<0.05 | ||||||
|
| 注:PI为外周灌注指数,Pv-aCO2/Ca-vO2为静脉-动脉血二氧化碳分压差与动脉-静脉血氧含量差比值 图 1 入院24 h内PI、Pv-aCO2/Ca-vO2及联合指标对AHF合并低灌注患者预后预测的ROC曲线 Fig 1 ROC curves of PI, Pv-aCO2/Ca-vO2, and combined indicators for predicting the prognosis of patients with acute heart failure and hypoperfusion within 24 hours of admission |
|
|
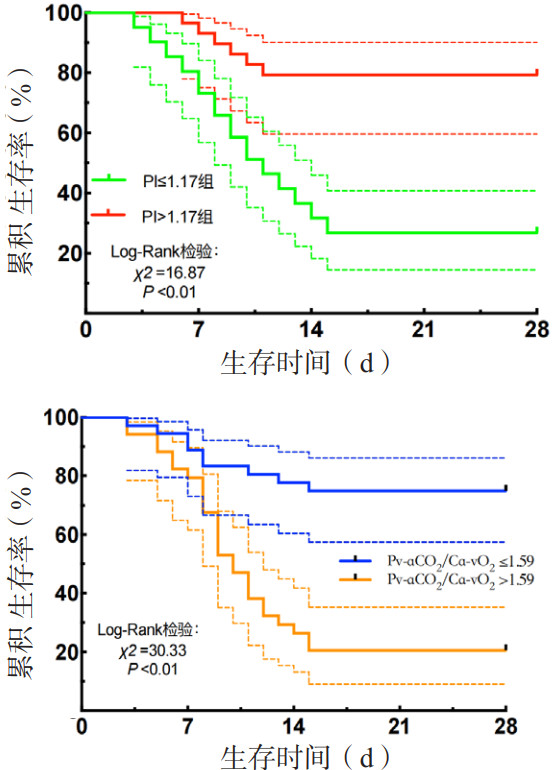
以外周灌注指数、Pv-aCO2/Ca-vO2预测AHF伴组织低灌注患者28 d预后最佳截断值分别进行亚组生存曲线分析,结果显示,PI≤1.17组28 d病死率高于PI>1.17组(Log-Rank检验χ2=16.87,P<0.01);Pv-aCO2/Ca-vO2>1.59组28 d病死率高于Pv-aCO2/Ca-vO2≤1.59组(Log-Rank检验χ2=30.33,P<0.01)。见图 2。
|
| 注:PI为外周灌注指数,Pv-aCO2/Ca-vO2为静脉-动脉血二氧化碳分压差与动脉-静脉血氧含量差比值;虚线为95%CI 图 2 不同组AHF合并低灌注患者28 d Kaplan-Meier生存曲线分析 Fig 2 28 day Kaplan-Meier survival curve analysis of acute heart failure patients with hypoperfusion in different groups |
|
|
心力衰竭是由于心脏结构或功能异常导致心室充盈或射血能力受损的一组临床综合征,其病理生理学特征为肺淤血和(或)体循环淤血、伴或不伴有组织器官低灌注。Lac浓度是反映组织灌注情况的替代指标,Lac浓度升高常提示早期器官功能障碍。AHF患者也存在组织低灌注,故在最新的AHF指南中,仍推荐予以Lac评估患者的组织灌注情况[4]。现有的研究显示[5-6],在AHF患者中,高Lac是评估患者预后的重要危险因素,这提示AHF患者的早期组织灌注不良与远期并发症发生率及病死率息息相关。然而,高乳酸血症也可由有氧糖酵解产生,与细胞缺氧无相关性[7-8]。因此,本研究使用反映组织缺氧更特异的指标Pv-aCO2/Ca-vO2联合PI来早期识别,对于改善AHF合并组织低灌注患者的预后至关重要。
Pv-aCO2/Ca-vO2代表机体CO2的生成量和氧消耗量之间的比值。在无氧代谢时,只有CO2的产生,却无O2的消耗,因此当组织低灌注缺氧时Pv-aCO2/Ca-vO2增加,其水平随组织低灌注严重程度而逐渐增加,是新的评估组织缺氧的指标[9]。大量临床研究已提示,休克早期复苏后ScvO2正常并不能保证组织灌注和细胞氧代谢的恢复[10]。亦有研究发现,维持充足全身氧输送并不能完全保证细胞氧代谢恢复,复苏后Pv-aCO2/Ca-vO2比值升高是乳酸未清除的独立危险因素,监测Pv-aCO2/Ca-vO2比值有助识别高乳酸是细胞缺氧相关抑或非缺氧相关,相较乳酸能更特异性反映组织缺氧,所以Pv-aCO2/Ca-vO2比值可作为潜在复苏目标[11]。Lundin等[12]研究发现Pv-aCO2/Ca-vO2预测脓毒性休克患者全身无氧代谢的能力优于Lac和ScvO2等传统标志物。且有研究表明在心脏外科术后伴高乳酸血症患者Pv-aCO2/Ca-vO2异常升高>1.6提示存在无氧代谢,即存在组织缺氧并伴有病死率升高[13]。王雪婷等[14]报道Pcv-aCO2/Ca-cvO2是脓毒性休克患者28 d死亡的独立危险因素,最佳截断值为1.47。本研究显示,入院24 h内Pv-aCO2/Ca-vO2>1.59的AHF伴组织低灌注患者28 d病死率显著升高,与上述研究结果基本相似。因此,早期Pv-aCO2/Ca-vO2>1.59可作为AHF伴组织低灌注患者预后预测的指标。
PI是近年来应用在临床的一种新型监测手段,可无创、动态、实时反映末梢血流灌注变化[15]。作为临床简便易得的无创指标,研究已证实能敏感地反映局部搏动信号与非搏动信号的比值,可评价局部组织血流灌注情况[16]。目前学术界认为,正常PI在1.4以上,若PI小于0.6为外周灌注中重度受损[17]。研究表明,PI<1.4提示脓毒性休克患者死亡风险较高,PiCCO导向复苏后PI<0.2预测ICU患者死亡的敏感度为65%、特异度为92%[18]。刘倩等[19]研究报道PI预测脓毒性休克患者28 d死亡的AUC为0.828,最佳截断值0.52。本研究显示,入院24 h内PI≤1.17的AHF伴组织低灌注患者28 d病死率显著升高,与上述研究在截断值方面存在一定差异,考虑与上述研究年龄、研究疾病及PI观察时间不同等因素相关,但均提示PI数值越低,死亡风险越高,需要引起临床医生高度重视。
综上,Pv-aCO2/Ca-vO2联合PI可作为AHF合并组织低灌注患者预后预测及治疗效果评价的有效指标。但是本研究仍有许多不足之处,首先,本研究仅在单中心进行;其次,本研究以患者28 d结局作为观察终点,未考虑到其他脏器功能损伤的发生、血管活性药物的使用、呼吸机的使用、及体外辅助设备的使用等所带来的影响;最后,本研究样本量有限,结果是否有效仍然是未知数,需要在接下来多中心及更大规模样本的前瞻性研究中证实。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张宏亮、吴丹:酝酿研究设计、论文撰写;陈立文、鲍磊:数据收集及整理、统计学分析;秦海东:研究设计修改、论文修改
| [1] | 中国医疗保健国际交流促进会急诊医学分会, 中华医学会急诊医学分会, 中国医师协会急诊医师分会, 等. 急性心力衰竭中国急诊管理指南(2022)[J]. 中华急诊医学杂志, 2022, 31(8): 1016-1041. DOI:10.3760/cma.j.issn.1671-0282.2022.08.003 |
| [2] | Wang XT, Gao XH, Cao W, et al. Prognostic value of arterial lactate combined with central venous-to-arterial carbon dioxide difference to arterial-to-central venous oxygen content difference ratio in septic shock patients[J]. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue, 2020, 32(1): 39-43. DOI:10.3760/cma.j.cn121430-20191226-00007 |
| [3] | Yu C, Fan WJ, Shao M. The predictive value of central venous-arterial CO2 difference/arterial-central venous O2 difference ratio for progressive organ dysfunction in patients with septic shock after resuscitation[J]. Zhonghua Nei Ke Za Zhi, 2021, 60(6): 533-538. DOI:10.3760/cma.j.cn112138-20201120-00959 |
| [4] | McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure[J]. Eur Heart J, 2021, 42(36): 3599-3726. DOI:10.1093/eurheartj/ehab368 |
| [5] | Uyar H, Yesil E, Karadeniz M, et al. The effect of high lactate level on mortality in acute heart failure patients with reduced ejection fraction without cardiogenic shock[J]. Cardiovasc Toxicol, 2020, 20(4): 361-369. DOI:10.1007/s12012-020-09563-9 |
| [6] | Gjesdal G, Braun OÖ, Gustav Smith J, et al. Blood lactate is a predictor of short-term mortality in patients with myocardial infarction complicated by heart failure but without cardiogenic shock[J]. BMC Cardiovasc Disord, 2018, 18(1): 8. DOI:10.1186/s12872-018-0744-1 |
| [7] | Bou Chebl R, Jamali S, Sabra M, et al. Lactate/albumin ratio as a predictor of in-hospital mortality in septic patients presenting to the emergency department[J]. Front Med (Lausanne), 2020, 7: 550182. DOI:10.3389/fmed.2020.550182 |
| [8] | Hernandez G, Bellomo R, Bakker J. The ten pitfalls of lactate clearance in sepsis[J]. Intensive Care Med, 2019, 45(1): 82-85. DOI:10.1007/s00134-018-5213-x |
| [9] | Padar M, Starkopf J, Starkopf L, et al. Enteral nutrition and dynamics of citrulline and intestinal fatty acid-binding protein in adult ICU patients[J]. Clin Nutr ESPEN, 2021, 45: 322-332. DOI:10.1016/j.clnesp.2021.07.026 |
| [10] | Mesquida J, Espinal C, Saludes P, et al. Central venous-to-arterial carbon dioxide difference combined with arterial-to-venous oxygen content difference (PcvaCO2/CavO2) reflects microcirculatory oxygenation alterations in early septic shock[J]. J Crit Care, 2019, 53: 162-168. DOI:10.1016/j.jcrc.2019.06.013 |
| [11] | 何怀武, 刘大为, 隆云, 等. 外周灌注指数和静-动脉血二氧化碳分压差/动-静脉血氧含量差比值评估脓毒症复苏后乳酸清除的研究[J]. 中华内科杂志, 2018, 57(12): 917-921. DOI:10.3760/cma.j.issn.0578-1426.2018.12.008 |
| [12] | Lundin A, Dell'anna AM, Peluso L, et al. Veno-arterial CO2 difference and respiratory quotient after cardiac arrest: an observational cohort study[J]. J Crit Care, 2021, 62: 131-137. DOI:10.1016/j.jcrc.2020.12.002 |
| [13] | Du W, Long Y, Wang XT, et al. The use of the ratio between the veno-arterial carbon dioxide difference and the arterial-venous oxygen difference to guide resuscitation in cardiac surgery patients with hyperlactatemia and normal central venous oxygen saturation[J]. Chin Med J (Engl), 2015, 128(10): 1306-1313. DOI:10.4103/0366-6999.156770 |
| [14] | 王雪婷, 高雪花, 曹雯, 等. 血乳酸联合中心静脉-动脉血二氧化碳分压差与动脉-中心静脉血氧含量差比值预测脓毒性休克患者预后的应用价值[J]. 中华危重病急救医学, 2020(1): 39-43. DOI:10.3760/cma.j.cn121430-20190916-00023 |
| [15] | Sun XT, He HW, Xu MR, et al. Peripheral perfusion index of pulse oximetry in adult patients: a narrative review[J]. Eur J Med Res, 2024, 29(1): 457. DOI:10.1186/s40001-024-02048-3 |
| [16] | Hasanin A, Karam N, Mukhtar AM, et al. The ability of pulse oximetry-derived peripheral perfusion index to detect fluid responsiveness in patients with septic shock[J]. J Anesth, 2021, 35(2): 254-261. DOI:10.1007/s00540-021-02908-w |
| [17] | 伍卓文, 高子娴, 舒鑫妮, 等. 外周灌注指数联合qSOFA评分预警分层评估急诊感染患者的临床价值[J]. 中国急救医学, 2021, 41(9): 755-758. DOI:10.3969/j.issn.1002-1949.2021.09.004 |
| [18] | He HW, Liu DW, Long Y, et al. The peripheral perfusion index and transcutaneous oxygen challenge test are predictive of mortality in septic patients after resuscitation[J]. Crit Care, 2013, 17(3): R116. DOI:10.1186/cc12788 |
| [19] | 刘倩, 王啸, 袁会敏, 等. 外周灌注指数联合中心静脉-动脉二氧化碳分压差/动脉-中心静脉氧含量差对脓毒性休克患者预后的预测价值[J]. 中华急诊医学杂志, 2022, 31(4): 508-513. DOI:10.3760/cma.j.issn.1671-0282.2022.04.014 |
 2025, Vol. 34
2025, Vol. 34