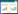2. 成都中医药大学医学与生命科学学院,成都 610075;
3. 川北医学院临床医学院,南充 637100;
4. 四川省医学科学院·四川省人民医院(电子科技大学附属医院)老年重症医学科,成都 610071
2. Department of School of Medical and Life Sciences, Chengdu University of Traditional Chinese Medicine, Chengdu 610075, China;
3. Department of Clinical Medical, North Sichuan Medical College, Nanchong 637100, China;
4. Department of Geriatric Intensive Care Unit, Sichuan Provincial People's Hospital, University of Electronic Science and Technology, Chengdu 610071, China
李斯特菌属是一种兼性厌氧的革兰阳性杆菌,细胞内寄生菌,呈单个或短链排列。它包含两种致病物种,单核细胞增生李斯特菌和伊万诺维乳杆菌[1]。感染人类的病菌主要是单核细胞增生性李斯特菌(Listeria. monocytogenes,LM),导致李斯特菌病(Listeriosis)[2]。人类主要通过摄入受污染的食物导致感染,李斯特菌主要寄居在人体肠道内,免疫力低下时可引起血流感染及颅内感染,导致腹泻、菌血症、脑膜炎和脑干炎等[3-4]。虽然李斯特菌感染发病率不高(0.1~10.0例/100万),但病死率高达20%~30% [5]。因此对李斯特菌病明确诊断及有效治疗能改善患者预后,提高患者生存率。
1 资料与方法 1.1 研究对象本研究对象为2014年2月1日至2024年1月31日就诊于四川省医学科学院·四川省人民医院被诊断为LM感染,其诊断标准:有或无明确病因、有感染症状,通过血培养、血NGS、脑脊液培养或脑脊液NGS明确诊断有LM,年龄在18~90岁。排除:妊娠期李斯特菌感染;排除18岁以下人群。本研究为回顾性研究,免除知情同意,获得四川省人民医院医学伦理委员会审批标准,批号:伦审(研)2024年第204号。
1.2 研究方法采用回顾性分析的方法,收集四川省人民医院2014年2月至2024年1月诊断为单核细胞增生性李斯特菌感染患者的性别、年龄、发病时间、临床表现、实验室检查、治疗及预后情况。文献检索:分别以“李斯特菌”“单核细胞增生性李斯特菌”为检索词在知网、万方数据库,以“Listeria”“Listeria monocytogenes”在PubMed进行文献检索,检索时间为2014年2月至2024年1月期间的病例报道为单核细胞增生性李斯特菌感染的文献,收集临床资料,对患者的临床特征、诊疗经过及预后进行总结分析。
1.3 统计方法根据患者预后进行分组,预后良好定义为患者病情好转出院。预后不良定义为病情恶化或者死亡出院。免疫力低下定义为长期服用激素或免疫抑制剂、肿瘤及放化疗的患者。使用SPSS 25.0和Graphpad 9进行分析,计数资料应用中位数及四分位数表示,计量资料以均数±标准差(x±s)表示。正态分布用成组t检验,不符合正态分布用非参数检验。二元Logistics回归分析预后不良的因素,以P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料在四川省人民医院收集到诊断为LM感染的17例患者,年龄(61.29±16.24)岁。其中女性8例,男性9例。合并主动脉夹层、乙肝、白血病、前列腺癌、高血压各1例,合并糖尿病3例,合并免疫系统疾病2例。发病到就诊的时间为3(1, 9)d。免疫低下占41.18%(7/17)。基本特征主要见表 1。
| 序号 | 性别 | 年龄 | 感染类型 | 合并脓毒症 | Sofa评分 | 诱因 | 合并症 | 发病时间 |
| 1 | 女 | 61 | 血流感染 | 有 | 2 | 无 | AD | 2 |
| 2 | 女 | 59 | 血流合并颅内感染 | 有 | 7 | 免疫低下 | SS, DM | 2 |
| 3 | 男 | 68 | 血流合并颅内感染 | 有 | 4 | 无 | 无 | 9 |
| 4 | 男 | 67 | 血流合并颅内感染 | 有 | 5 | 受凉 | DM | 3 |
| 5 | 男 | 22 | 血流合并颅内感染 | 无 | 1 | 受凉 | HBV | 6 |
| 6 | 女 | 59 | 血流感染 | 无 | 1 | 免疫低下 | 白血病 | 5 |
| 7 | 女 | 33 | 血流感染 | 无 | 1 | 清宫术后 | 无 | 7 |
| 8 | 男 | 81 | 血流合并颅内感染 | 有 | 6 | 无 | 无 | 1 |
| 9 | 女 | 57 | 血流合并颅内感染 | 有 | 4 | 无 | 无 | 3 |
| 10 | 男 | 83 | 血流感染 | 有 | 3 | 受凉 | 无 | 2 |
| 11 | 女 | 83 | 血流合并颅内感染 | 有 | 4 | 受凉 | DM | 1 |
| 12 | 女 | 51 | 颅内感染 | 无 | 1 | 免疫低下 | SLE | 3 |
| 13 | 女 | 51 | 颅内感染 | 无 | 0 | 免疫低下 | SS | 3 |
| 14 | 男 | 66 | 颅内感染 | 无 | 0 | 无 | 高血压 | 3 |
| 15 | 男 | 65 | 血流感染 | 无 | 1 | 化疗 | CSCO | 3 |
| 16 | 男 | 61 | 血流感染 | 无 | 1 | 无 | 无 | 2 |
| 17 | 男 | 75 | 血流感染 | 有 | 4 | 无 | 痛风 | 3 |
| 注:AD主动脉夹层;SS:干燥综合征;DM:糖尿病;HBV:乙肝病毒;SLE:系统性红斑狼疮;CSCO:前列腺癌 | ||||||||
17例患者均有畏寒、发热,其中低热(37.5~38.0℃) 1例, 中高热(38.1~40.4℃) 14例, 超高热(> 40.5℃) 2例。8例患者有头痛、意识障碍。9例患者合并脓毒症。3例患者合并肾功能不全,1例合并肝功能不全,5例合并横纹肌损伤,8例患者合并心功能不全。患者的白细胞总数、N%、CRP、PCT分别为(10.48±3.90)×109 g/L、(78.10±16.02)%、(118.10±84.72)mg/L、(4.32±6.79)ng/mL。
2.3 治疗及预后发病至经验用药的平均时间为72 h,发病至确诊的平均时间为102 h,确诊后使用的抗生素主要为青霉素、美罗培南及万古霉素等。平均住院时间16 d,9例患者预后不佳。治疗使用抗菌药物疗程及预后见表 2。
| 病例 | 发病至经验用药时间(h) | 经验性抗生素的种类 | 经验性抗生素时间(d) | 发病至确诊时间(h) | 确诊后抗生素的种类 | 确诊后抗生素时间(d) | 住院时间(d) | 预后 |
| 1 | 48 | 派拉西林他唑巴坦 | 5 | 168 | 舒普深 | 14 | 19 | 良好 |
| 2 | 96 | 头孢他定+舒普深 | 2 | 144 | 万古霉素+美罗培南 | 18 | 20 | 不良 |
| 3 | 216 | 舒普深 | 2 | 264 | 左氧氟沙星美罗培南 | 10 | 12 | 不良 |
| 4 | 72 | 头孢曲松 | 2 | 48 | 万古霉素+美罗培南 | - | 8 | 不良 |
| 5 | 144 | 美洛西林他唑巴坦+头孢曲松 | 3 | 216 | 美罗培南 | 3 | 5 | 不良 |
| 6 | 72 | 头孢克肟 | 2 | 48 | 美罗培南 | 9 | 10 | 良好 |
| 7 | 72 | 头孢曲松 | 4 | 5 | 青霉素 | 8 | 6 | 不良 |
| 8 | 24 | 美罗培南+万古霉素+左氧氟沙星 | 1 | 3 | 青霉素 | 14 | 12 | 不良 |
| 9 | 72 | 头孢曲松+美罗培南+复方甲噁唑 | 3 | 144 | 青霉素+磺胺甲噁唑 | 14 | 17 | 不良 |
| 10 | 48 | 美罗培南+左氧氟沙星 | 2 | 96 | 青霉素+左氧氟沙星+阿米卡星 | 35 | 37 | 良好 |
| 11 | 24 | 派拉西林他唑巴坦头孢他定 | 2 | 120 | 头孢他定 | 1 | 2 | 不良 |
| 12 | 72 | 美罗培南+万古霉素 | 4 | 168 | 青霉素+万古霉素 | 14 | 18 | 良好 |
| 13 | 72 | 美罗培南+万古霉素 | 4 | 168 | 青霉素 | 43 | 25 | 良好 |
| 14 | 72 | 美罗培南 | 4 | 6 | 美罗培南+头孢他定+青霉素 | - | 36 | 良好 |
| 15 | 0 | - | 0 | 3 | 派拉西林他唑巴坦 | - | 13 | 良好 |
| 16 | 48 | 美罗培南+万古霉素 | 2 | 3 | 青霉素 | 12 | 13 | 良好 |
| 17 | 72 | 美罗培南 | 6 | 144 | 派拉西林他唑巴坦 | 29 | 23 | 不良 |
本研究共检索到78篇文章,共报道85个病例,收集文献报道的临床资料,对患者的临床特征、诊疗经过及预后进行分析。患者年龄(57.96±16.48)岁。女性占49.41%(42/85),男性占50.59%(43/85)。血流感染者26例,颅内感染者44例,普通感染者15例,合并脓毒症患者占43.9%(18/41)。有11例患者明确报道了不洁饮食史(如生肉、未杀菌的牛奶),27例患者长期使用激素或免疫抑制剂或化疗药,3例为透析患者。23例患者合并糖尿病,19例患者合并自身免疫病,6例患者合并肿瘤。白细胞总数为(13.69±7.24)×109 g/L,CRP为(154.59±163.01)mg/L。主要确诊方法为血/脑脊液的培养或NGS。患者发病到就诊时间为3(1, 7)d,住院时间为21(14, 39)d,确诊后使用抗生素的时间为22(14, 42)d。患者确诊后主要使用的青霉素类(氨苄西林)、氨基糖苷类(庆大霉素)、碳青霉烯类(美罗培南)、糖肽类抗生素(万古霉素)等抗生素。患者预后不良占30.6%(26/85)。
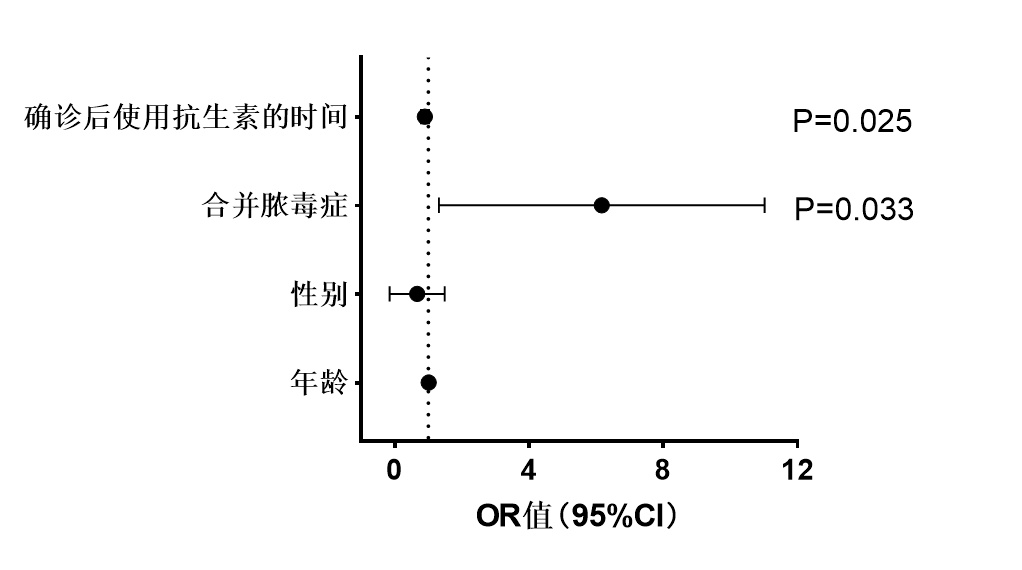
将所有(本院和文献中)患者根据预后情况分为预后良好组和预后不良组,其中预后良好组共66例,预后不良组共36例,预后不良组合并更多的脓毒症患者且确诊后使用抗生素的时间越短,差异具有统计学意义(P<0.05),两组在性别、年龄、危险因素、感染类型、发病及住院时间、抗生素的种类差异无统计学意义,见图 1。Logistics回归分析发现是否合并脓毒症、确诊后抗生素使用的时间是预后不良的独立危险因素(图 2)。
|
| 图 1 预后良好组和预后不良组的比较 Fig 1 Comparison between the good prognosis group and the poor prognosis group |
|
|
|
| 图 2 不良预后组多因素Logistic回归的森林图 Fig 2 Forest plot of multivariable Logistic regression for the poor prognosis group |
|
|
LM为革兰阳性兼性厌氧菌,耐低温,可通过污染食物(如冷藏食品)感染免疫力低下人群,可引起胃肠炎、脓毒症、中枢神经系统症状(脑膜炎、脑炎)等,导致高住院率和病死率[2, 5-7]。本研究中发现30.6%(26/85)患者预后不良,诱因多为食用不卫生的饮食如冰箱冷藏食物以及受凉导致免疫力低下。
本文发现颅内感染者和非颅内感染的预后差异无统计学意义。这可能与患者年龄、基础疾病以及合并其他感染有关。然而一项大型的前瞻性研究显示血培养阳性患者感染中枢性李斯特菌病病死率更高,最强的死亡预测因素是器官功能障碍、单核细胞减少症及癌症[8]。合并神经系统感染是重症李斯特菌相关感染的主要危险因素[9]。通过Logistics回归分析发现合并脓毒症患者,抗生素使用时间越短,患者预后不良的风险就越高。及时有效的使用抗生素可改善患者预后[10]。另一项Meta分析显示老年患者(年龄≥60岁)、中枢神经系统感染、合并慢性肾病、心血管疾病和肺部疾病均是李斯特菌感染预后不良的高危因素[11]。积极识别可能导致患者预后不良的高危因素并进行有效的干预可改善患者预后,提高临床疗效[12]。
由于临床表现、实验检查结果不典型,从血液或脑脊液中培养出LM是诊断李斯特菌病的金标准[13]。脑脊液和血培养的阳性率分别为41%和61% [14],而基因二代测序(mNGS)阳性率为100% [15],mNGS有更高的敏感度[16]。对于疑似病例选用NGS可提高检出率。
LM天然对β-内酰胺类抗生素敏感,李斯特菌病的标准抗生素治疗方案包括青霉素/氨苄西林单药或与庆大霉素联合使用[17-18]。青霉素过敏患者,用复方磺胺甲噁唑(TMP-SMX)。美罗培南或利奈唑胺是有效的二线用药[19]。喹诺酮类药物和利福平对LM感染也有很好的效果,因其很容易穿透血脑屏障。本研究对使用抗生素方案进行分组,发现各组间预后差异无统计学意义。这可能与李斯特菌有效侵入宿主细胞和增殖(如巨噬细胞、肝细胞和神经元)以促进逃避抗生素的细胞毒性作用有关;还可能与患者合并其他细菌或其他部位的感染相关。免疫功能正常的患者,菌血症治疗2周,而治疗CNS感染者需要2~4周。免疫功能受损的患者,菌血症治疗3~6周,而CNS感染者最好治疗4~8周。综合本文对李斯特菌感染患者的情况,初始经验性选用头孢类或加酶抑制剂等抗生素,明确诊断后多选用青霉素/氨苄西林等抗生素,血流感染患者联用美罗培南、万古霉素等抗生素,而颅内感染者多选用氨苄西林联合庆大霉素等抗感染。
本研究的局限性:本文主要为回顾性的研究,收集数据库收录的个案文献,部分患者的临床资料收集不完整,导致无法全面评估研究患者的特征。且本文病例数不多,后续需要大样本多中心的研究进一步对LM患者进行研究。
综上所述,本研究总结以下的经验教训:(1)LM是条件致病菌,多数自限,但在免疫低下、老年人的患者中,它可以导致患者预后不良,对此类患者应尽早识别;(2)避免食用未经巴氏消毒的乳酪、牛奶熟食及冰箱冷藏食物,可以减少高危人群患病;(3)李斯特菌主要诊断方法主要为血/脑脊液的培养或NGS;(4)青霉素及氨苄西林是主要抗感染方案,合并颅内感染者,在评估患者肾功能的情况下及时联用复方磺胺甲噁唑或庆大霉素;(5)在发现李斯特菌感染时,早期启动适当的抗菌治疗可以降低病死率。
利益冲突 所有作者声明无利益冲突
作者贡献声明 龙怀聪负责研究设计及论文修改;郑新负责论文撰写积及投稿;郑义雄、蒋夏敏、罗瑶、陈静、刘家琦、阿力木惹、何孜怡负责数据收集及整理及统计学分析
| [1] | Lecuit M. Listeria monocytogenes, a model in infection biology[J]. Cell Microbiol, 2020, 22(4): e13186. DOI:10.1111/cmi.13186 |
| [2] | Luque-Sastre L, Arroyo C, Fox EM, et al. Antimicrobial resistance in Listeria species[J]. Microbiol Spectr, 2018, 6(4): 10.1128/microbiolspec. arba-10.1128/microbiolspec. 0031-2017. DOI: 10.1128/microbiolspec.ARBA-0031-2017. |
| [3] | Ahmadi A, Ramazanzadeh R, Derakhshan S, et al. Prevalence of Listeria monocytogenes infection in women with spontaneous abortion, normal delivery, fertile and infertile[J]. BMC Pregnancy Childbirth, 2022, 22(1): 974. DOI:10.1186/s12884-022-05330-6 |
| [4] | Pagliano P, Ascione T, Boccia G, et al. Listeria monocytogenes meningitis in the elderly: epidemiological, clinical and therapeutic findings[J]. Infez Med, 2016, 24(2): 105-111. |
| [5] | Lomonaco S, Nucera D, Filipello V. The evolution and epidemiology of Listeria monocytogenes in Europe and the United States[J]. Infect Genet Evol, 2015, 35: 172-183. DOI:10.1016/j.meegid.2015.08.008 |
| [6] | Craig AM, Dotters-Katz S, Kuller JA, et al. Listeriosis in pregnancy: a review[J]. Obstet Gynecol Surv, 2019, 74(6): 362-368. DOI:10.1097/OGX.0000000000000683 |
| [7] | Zhang HQ, Luo X, Aspridou Z, et al. The prevalence and antibiotic-resistant of Listeria monocytogenes in livestock and poultry meat in China and the EU from 2001 to 2022: a systematic review and Meta-analysis[J]. Foods, 2023, 12(4): 769. DOI:10.3390/foods12040769 |
| [8] | Charlier C, Perrodeau É, Leclercq A, et al. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study[J]. Lancet Infect Dis, 2017, 17(5): 510-519. DOI:10.1016/S1473-3099(16)30521-7 |
| [9] | Beamonte Vela BN, Garcia-Carretero R, Carrasco-Fernandez B, et al. Listeria monocytogenes infections: analysis of 41 patients[J]. Med Clin (Barc), 2020, 155(2): 57-62. DOI:10.1016/j.medcli.2019.09.023 |
| [10] | 罗雅尹, 韩杰, 李婉婷, 等. 老年重症李斯特菌脑膜炎1例[J]. 中华老年医学杂志, 2023, 42(8): 985-987. DOI:10.3760/cma.j.issn.0254-9026.2023.08.018 |
| [11] | Huang C, Lu TL, Yang YL. Mortality risk factors related to listeriosis: a Meta-analysis[J]. J Infect Public Health, 2023, 16(5): 771-783. DOI:10.1016/j.jiph.2023.03.013 |
| [12] | 姜秀国, 王辉, 顾明, 等. 成人社区获得性单核细胞增生李斯特菌脑膜炎[J]. 中华急诊医学杂志, 2012, 21(10): 1140-1146. DOI:10.3760/cma.j.issn.1671-0282.2012.10.018 |
| [13] | Charlier C, Poirée S, Delavaud C, et al. Imaging of human neurolisteriosis: a prospective study of 71 cases[J]. Clin Infect Dis, 2018, 67(9): 1419-1426. DOI:10.1093/cid/ciy449 |
| [14] | Yao M, Zhou JL, Zhu YC, et al. Detection of Listeria monocytogenes in CSF from three patients with meningoencephalitis by next-generation sequencing[J]. J Clin Neurol, 2016, 12(4): 446-451. DOI:10.3988/jcn.2016.12.4.446 |
| [15] | Li J, Zhang Y, Zhang QQ, et al. Application of metagenomic next-generation sequencing for the diagnosis of intracranial infection of Listeria monocytogenes[J]. Ann Transl Med, 2022, 10(12): 672. DOI:10.21037/atm-22-2186 |
| [16] | Xing XW, Zhang JT, Ma YB, et al. Metagenomic next-generation sequencing for diagnosis of infectious encephalitis and meningitis: a large, prospective case series of 213 patients[J]. Front Cell Infect Microbiol, 2020, 10: 88. DOI:10.3389/fcimb.2020.00088 |
| [17] | Hanes RM, Huang ZY. Investigation of antimicrobial resistance genes in Listeria monocytogenes from 2010 through to 2021[J]. Int J Environ Res Public Health, 2022, 19(9): 5506. DOI:10.3390/ijerph19095506 |
| [18] | Koluman A, Dikici A. Antimicrobial resistance of emerging foodborne pathogens: status quo and global trends[J]. Crit Rev Microbiol, 2013, 39(1): 57-69. DOI:10.3109/1040841X.2012.691458 |
| [19] | Obaidat MM, Bani Salman AE, Lafi SQ, et al. Characterization of Listeria monocytogenes from three countries and antibiotic resistance differences among countries and Listeria monocytogenes serogroups[J]. Lett Appl Microbiol, 2015, 60(6): 609-614. DOI:10.1111/lam.12420 |
 2025, Vol. 34
2025, Vol. 34