肺血栓栓塞症(pulmonary thromboembolism, PTE)是静脉血栓栓塞症(venous thromboembolism, VTE)最严重的临床表现之一,全球疾病负担居于循环系统疾病前列[1]。80%以上的PTE是因深静脉血栓形成(deep vein thrombosis,DVT)的栓子脱落后阻塞肺动脉而成,进而导致肺动脉压力升高、损害右心结构和功能,甚至引起右心衰竭与死亡[2-3]。提升PTE诊断和治疗能力对减少PTE相关的病死率和复发率、改善患者预后、减轻医疗负担至关重要。出凝血功能检测通过评估基线凝血状态辅助排除抗凝禁忌症、优化抗栓治疗安全性;通过动态监测凝血指标指导个体化抗凝治疗,从而减少出血或血栓复发风险,提升医疗质量并降低长期医疗负担具有不可替代的作用[4]。然而,由于PTE发病机制涉及多环节且存在显著的个体差异,现有出凝血功能检测在PTE风险分层和抗凝方案优化中的临床应用仍存在局限性。本共识充分整合现有证据和专家意见,旨在指导PTE患者诊疗中出凝血功能检测的应用,为临床医师提供诊疗证据,最终达到提升PTE患者临床疗效和改善预后的目的。
1 《共识》形成方法 1.1 专家组成员本共识汇集了来自急诊医学、重症医学、检验医学、呼吸病学以及护理学等不同领域的专家,以确保共识内容的全面性和权威性。
1.2 文献检索本共识的文献检索数据库包括PubMed、Embase、中国知网和万方数据知识服务平台。根据临床问题进行证据检索,英文以“Pulmonary Embolism(PE)或者Pulmonary Thromboembolism(PTE)”和“Coagulation Function”等为关键词;中文检索关键词以“肺栓塞”或者“肺血栓栓塞症”和“出凝血功能”等为关键词;检索时限为建库至2025年2月。纳入研究涉及PTE凝血功能检测的系统性综述和荟萃分析、随机对照研究和回顾性研究等,剔除重复文献、述评、编辑点评、来信和新闻报道等。本共识已在国际实践指南注册与透明化平台(http://www.guidelines-registry.cn/)注册,注册号为PREPARE-2025CN304。
1.3 方法学基于德尔菲法[5]实现专家共识,采用专家组投票的形式决定意见推荐分级,推荐分级分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级,推荐分级及其代表意义见表 1。
| 推荐分级 | 代表意义 |
| Ⅰ级 (一致推荐或一致不推荐) |
投票100%一致,所有专家完全达成共识 |
| Ⅱ级 (强推荐或强不推荐) |
投票75%~99%一致,绝大多数专家达成共识 |
| Ⅲ级 (弱推荐或弱不推荐) |
投票50%~74%一致,多数专家达成共识,但少数专家存在分歧 |
| Ⅳ级 (专家未达成一致性结论) |
投票 < 50%一致,专家未达成一致性结论 |
最新的美国心脏协会2024年数据报告显示,美国每年约有40万PTE患者[6-7]。2019年,我国肺栓塞与肺血管病防治协作组发表的中国VTE住院和住院病死率数据显示,我国PTE患者的住院率为7.1/10万人,住院病死率为3.9%[8]。另外,统计数据显示,34%的PTE患者在治疗前或疾病早期死亡,其中7%生前得到确诊,59%的患者在死后才被诊断[9-10]。一项多中心回顾性研究涵盖2009至2015年的7 438名成年急性症状性PTE患者,研究显示高、中、低风险患者的比例分别为4.2%、67.1%和28.7%[11]。
2.2 临床表现PTE临床表现多样且缺乏特异性,其严重程度取决于血栓的大小、数量、位置以及患者是否存在心肺基础疾病等因素,症状涵盖无症状至休克甚至猝死。文献报道显示,约80%患者会有不同程度的呼吸困难,70%患者经历胸痛,约40%患者出现咳嗽以及30%患者出现咯血,还有患者出现晕厥或猝死等[12]。约20%的PTE患者出现呼吸困难、胸痛及咯血的“三联征”[13]。PTE患者常见的体征包括循环系统和呼吸系统的异常。
循环系统方面,窦性心动过速最为常见[14]。呼吸系统方面,一旦表现为发绀和呼吸频率加快,多提示存在严重的肺通气/血流比例失调和低氧血症。
2.3 诊断标准参照欧洲心脏病学会(European Society of Cardiology, ESC)发布的《2019 ESC急性肺栓塞诊断与治疗指南》[15],急性PTE诊断应先判定血流动力学的稳定性,然后进行临床可能性评估,再进行临床风险分层,最后根据危险分层选择检查以明确诊断。
根据患者的临床表现和体征判定患者的血流动力学是否稳定。血流动力学不稳定包括三个内容[15]:心脏骤停;梗阻性休克,收缩压<90 mmHg或在血容量足够的情况下,仍需升压药维持使血压≥90 mmHg且周围器官低灌注状态;持续性低血压,收缩压下降≥40 mmHg持续时间15 min以上(新发的心律失常、低血容量或败血症引起的血压下降除外)。对于血液动力学不稳定的高风险PTE患者,应根据患者的严重情况和紧急程度,建议选择经胸超声心动图(transthoracic echocardiography, TTE)、计算机断层扫描肺动脉血管造影(computed tomography pulmonary angiogram, CTPA)、肺通气/灌注显像(ventilation / perfusion, V/Q)、数字减影血管造影(digital subtraction angiography, DAS)或磁共振肺动脉造影(magnetic resonance pulmonary angiography, MRPA)进一步诊断。
对于血流动力学稳定的患者,可采用加拿大Wells评分[16]和修正的Geneva评分[17],评估患者发生PTE的可能性[18-19]。Wells评分含7项,0~1分表示低可能性,≥2分表示高可能性。Geneva评分含9项,0~2分表示低可能性,≥3分表示高可能性。对于中、低度可能性的患者建议进行高敏血浆D-Dimer的检测,阴性(低于临界值)通常可排除PTE。对于阳性(高于临界值)患者,可进一步明确诊断[15]。PTE一经诊断,建议采用的临床风险评估工具有肺栓塞严重度指数(pulmonary embolism severity index, PESI)及简化肺栓塞严重度指数(simplified pulmonary embolism severity index, sPESI)进行临床危险程度评估[20]。
3 出凝血功能检测在PTE诊断中的应用 3.1 凝血功能测定凝血功能是指血管损伤后,血液通过一系列复杂的酶促生化反应,迅速形成血栓以实现止血的过程。凝血功能检测在PTE诊断和治疗中具有重要的辅助价值。需要注意的是,特殊疾病(如抗磷脂抗体综合征)临床实践与检验的反向变化。
证据提示,TEG联合凝血指标的检测在PTE的诊断过程中具有辅助作用[21]。一项回顾性研究分析了433例经由CTPA确诊为PTE的患者,同期选择了28例健康对照,发现25.2%的患者AT指标降低,23.6%的患者FIB指标升高,提示FIB的升高和AT的降低与PTE相关可能性[22]。另有研究,发现抗磷脂综合征相关PTE患者,血小板水平降低而体外检测APTT延长,其原因是因为抗磷脂综合征患者存在磷脂抗体,所以表现出虽然体内高凝但是体外低凝的假象[23]。此外,一项观察性研究,通过人工智能的学习方法,识别出预测PTE发生的重要指标,包括APTT和血小板计数,该研究的预测模型曲线下面积(area under the curve,AUC)最大为0.776(95%CI: 0.774~0.778)[24]。然而,凝血功能检测在PTE诊断中的应用价值仍需进一步验证。
3.2 纤维蛋白溶解功能检测FDP和D-Dimer是纤维蛋白溶解功能中最主要的两个指标。研究显示,FDP作为纤溶系统被激活的标志物,腹腔镜术后FDP水平的增加能够预测患者发生VTE的风险[25]。此外,肺癌术后的静脉插管患者,血浆中FDP的升高与血栓的形成发生密切相关,且FDP在诊断血栓形成中的AUC为0.816[26],显示出较高的诊断价值。
大量证据提示D-Dimer的连续监测在PTE的辅助诊断中具有很高的阴性预测价值。D-Dimer是FDP中常用作血栓形成和继发纤溶活性的指标,有研究显示D-Dimer在肺栓塞后30 min能检测到变化,在2 h达到峰值[27]。2018年《肺血栓栓塞症诊治与预防指南》[28]和2023年《D-二聚体实验室检测与临床应用中国专家共识》[29]指出,D-Dimer对PTE阴性排除的敏感度在92%~100%,对于低度或中度PTE临床可能性患者具有较高的阴性预测价值,若D-Dimer含量<500 μg/L纤维蛋白原等价单位(fibrinogen equivalent unit, FEU),可基本排除急性PTE。一项Meta分析显示,Wells评分对住院PTE患者临床决策规则的敏感度是72.1%(95% CI,63.7~79.2),当增加了D-Dimer的检测,临床决策规则的敏感性为99.7%(95% CI,96.7%~100%),检测阴性在排除PTE的效率为8.4% (95% CI, 4.1%~16.5%),失败率仅为0.1%(95% CI,0%~5.3%),表明对于临床上怀疑PTE的患者使用Wells评分并结合D-Dimer来进行PTE的排除是安全且有效的[30]。2019年,美国肺栓塞救治团队(Pulmonary Embolism Response Team, PERT)联盟发布的《急性肺栓塞的诊断、治疗与随访:PERT联盟实践共识》[31]推荐当D-Dimer值检测≥ 500 μg/L FEU时,需要进行CTPA检查确诊PTE。
D-Dimer的水平随着年龄的增加而上升,共识推荐[31],针对老年PTE患者的诊断需要调整临界值为[ > 50岁患者的年龄(岁)]×10 μg/L FEU。一项多中心、跨国前瞻性研究发现,采用年龄调整临界值显著提高了基于D-Dimer排除PTE患者的比例,表明对于年龄>50岁的疑似PTE患者,使用年龄调整临界值在排除PTE阴性患者中具有重要价值[32]。一项队列研究显示,采用年龄校正的D-Dimer临界值进行检测,排除PTE阴性的预测值为99.5%[33]。另有三项观察性研究表明,针对50岁以上的患者的VTE诊断策略基于年龄调整的D-Dimer临界值是安全的,阴性预测值的准确度达到99%,同时调整D-Dimer临界值能够提高老年PTE患者诊断准确性和减少不必要的检查[34-36]。因此,在临床实践中,对于年龄>50岁的疑似PTE患者,建议采用年龄调整的D-Dimer临界值进行诊断,以提高诊断的准确性和安全性,减少不必要的进一步检查,为患者提供更合理的诊疗方案。
推荐意见1: 对于PTE低风险和中风险的患者,当D-Dimer水平<500 μg/L FEU,结合临床基本可排除急性PTE;对于>50岁疑似PTE的患者,适宜根据年龄调整的D-Dimer临界值年龄×10 μg/L FEU,进行阴性排除。(推荐等级:Ⅰ级)
4 出凝血功能检测的在PTE治疗中的应用凝血和纤溶系统分别负责止血和纤维蛋白溶解,共同维持血管完整性和血流的动态平衡。血管损伤,激活凝血系统,形成血栓以达到止血目的;纤维蛋白凝血块形成后和修复期,纤溶系统被激活溶解血栓,恢复血管通畅。在PTE患者中,血液凝固和纤溶系统失衡,导致静脉内血栓形成,血栓脱落阻塞至肺血管,引发的一系列肺循环阻力增加的病理生理变化综合征。PTE的治疗策略涵盖溶栓、抗凝、介入和手术治疗。溶栓激活纤溶酶原溶解血栓;抗凝疗法则抑制凝血因子活性,预防血栓进一步形成;介入治疗可以通过吸栓、碎栓、局部溶栓等治疗措施达到缓解病情的目的;对于存在右心血栓,原则上建议手术治疗。
4.1 出凝血功能检测在溶栓治疗过程中的应用对于急性高危PTE患者或者中高危PTE患者,伴有严重低氧血症、持续恶化的右心功能障碍,在无高出血风险的前提下,应考虑静脉溶栓治疗[37]。溶栓治疗可迅速缓解或纠正异常的血流动力学和氧合状态,降低病死率。不建议在中低危PTE中常规使用静脉溶栓治疗[38]。
在溶栓过程中,监测出凝血功能对评估溶栓适应证和禁忌证、治疗过程中的风险预警和疗效判断起关键作用,目前证据以指南和共识为主。相关指南[39]指出,对于有潜在出血倾向或凝血功能障碍的患者,当INR > 1.7、APTT>40 s或PT > 15 s的患者出血风险相对较高,溶栓的有效性和安全性未知,为溶栓相对禁忌。对于已使用华法林抗凝且INR > 1.7或PT > 15 s的患者,溶栓风险较高,是溶栓禁忌[39]。对于已经应用抗凝剂的患者继续原剂量抗凝,宜密切监测凝血观察出血征象。对于已知存在血小板减少病史、血小板计数<100×109/L纳入溶栓禁忌[39-41]。在治疗过程中,FIB<1.5 g/L为溶栓相对禁忌,建议在补充纤维蛋白原的同时适当使用小剂量溶栓剂;FIB<1.0 g/L,提示出血风险增高,应停止溶栓治疗;当FIB > 1.5 g/L时,可考虑溶栓治疗[42]。开始溶栓治疗前应测定APTT基础值,在溶栓治疗结束后,应监测APTT,每2~4 h测定1次,当APTT水平<基础值的2倍时,可以抗凝治疗[37, 43]。
推荐意见2:在对急性高危和中高危PTE患者实施溶栓治疗前或治疗过程中,宜密切监测患者的临床表现及INR,APTT,PT,FIB和血小板计数等出凝血功能指标,警惕溶栓治疗禁忌症的出现。(推荐意见:Ⅱ级)
4.2 出凝血功能检测在抗凝治疗过程中的应用抗凝为PTE治疗的基石,可以有效地防止血栓再形成和复发,同时促进机体自身纤溶活性溶解血栓。当高度怀疑急性PTE时,即应启动肠外抗凝治疗。抗凝治疗可通过肠外或口服方式进行。2018年《肺血栓栓塞症诊治与预防指南》[28]中指出凝血功能指标检测在临床指导PTE患者抗凝药物用量,抗凝药物选择以及抗凝疗程上具有重要的作用。
针对急性PTE患者,首选的胃肠外抗凝剂为低分子量肝素(vow molecular weight heparin, LMWH)。通常依据患者体重决定LMWH的给药剂量,如100 IU/Kg或者1 mg/kg,皮下注射,每日1~2次,不建议常规监测抗Ⅹa因子活性;但对于过度肥胖([身体重指数] BMI>40)、低体重(体重<50 kg)以及孕妇患者,需要依据血浆中抗Ⅹa因子活性调整给药剂量。皮下注射LMWH每日2次时,建议控制抗Ⅹa因子活性峰值水平范围为0.6~1.0 U/mL;皮下注射LMWH每日1次时,建议控制抗Ⅹa因子活性峰值在1.0~2.0 U/mL范围内。
使用普通肝素(unfractionated heparin, UFH)治疗,首先给予负荷剂量80 IU/kg静脉注射,继之以18 IU/ kg·h-1持续静脉滴注。APTT是评估肝素剂量的常用指标[44],开始治疗最初24 h内需每4 h测定一次APTT,依据APTT值调整给药剂量(表 2)[45-47]。当高剂量的UFH使用还不能使APTT达标,推荐依据抗Ⅹa因子活性水平调整给药剂量;UFH治疗时,应控制抗Ⅹa的峰值水平在0.3~0.7 U/mL[48]。因UFH可能引起血小板减少症(heparin-induced thrombocytopenia, HIT),需要在UFH使用后的每2~3 d内复查一次血小板计数[49]。一旦出现HIT或高度怀疑时,建议换用磺达肝癸钠、阿加曲班或比伐卢定。磺达肝癸钠的给药剂量由患者体重决定,每日1次皮下注射,通常无需监测抗Ⅹa因子活性。阿加曲班和比伐卢定同样按照患者体重给药,初始抗凝的目标是控制APTT在基础值的1.5~3倍之间。
| APTT检测 | 初始剂量及调整剂量 | 下次APTT测定的时间间隔(h) |
| 治疗前基础值 | 初始计量:80 IU·kg-1静脉注射,然后按照18 IU·kg-1·h-1静脉滴注 | 4~6 |
| <35 s(<1.2倍基础值) | 予80 IU·kg-1静脉注射,然后增加静脉滴注剂量4 IU·kg-1·h-1 | 6 |
| 35~45 s(1.2~1.5倍基础值) | 予40 IU/kg静脉注射,然后增加静脉滴注剂量2 IU·kg-1·h-1 | 6 |
| 46~70 s(1.5~2.3倍基础值) | 无需调整剂量 | 6 |
| 71~90 s(2.3~3.0倍基础值) | 减少静脉滴注剂量2 IU·kg-1·h-1 | 6 |
| >90 s(>3倍基础值) | 停药1 h,然后减少剂量3 IU·kg-1·h-1后恢复静脉滴注 | 6 |
| 注:UFH为普通肝素 | ||
初始抗凝结束后,根据患者临床情况转化为口服抗凝剂。常用的口服抗凝剂包括维生素K拮抗剂,凝血因子Ⅹa抑制剂和凝血酶抑制剂。维生素K拮抗剂主要是华法林,为抗凝治疗中常用的抗凝剂之一。一项随机对照试验研究发现,低剂量的华法林使用相较于安慰剂组,VTE复发风险降低64%[风险比:0.36,96%置信区间(CI):0.19~0.67,P<0.001][50]。华法林抗凝过程中,出凝血指标能够指导调整用药剂量。2013年《华法林抗凝治疗的中国专家共识》[51]指出,国人华法林的初始剂量建议为1~3 mg,对于高年龄以及出血风险高的患者可以适当降低剂量。华法林使用后INR在2~4周达标即达到2~3之间,在INR达标后每周测定1-2次,稳定后则4~12周测定一次[50]。相关指南[48, 52]和共识[53]建议,INR>3.0~4.5(无出血并发症):适当降低华法林剂量(5%~40%)或停服1次,6~12 h后复查INR,达标后以小剂量华法林重启治疗;INR>4.5~<10.0(无出血并发症):停用华法林,口服或静脉注射维生素K(1.0~2.5 mg),6~12 h后复查INR,达标后以小剂量华法林重启治疗;INR ≥ 10.0(无出血并发症):停用华法林,口服或静脉注射维生素K(5 mg),6~12 h后复查INR,达标后以小剂量华法林重启治疗。当INR<2时,适当增加华法林剂量(5%~25%),并加强INR检测。
凝血因子Ⅹa抑制剂和凝血酶抑制剂为口服抗凝剂,其中凝血因子Ⅹa抑制剂以利伐沙班、阿哌沙班和艾多沙班为主,凝血酶抑制剂为达比加群。直接口服抗凝剂治疗对大多数PTE患者是安全、有效和方便的治疗方法[54]。直接口服抗凝剂在强化治疗和维持治疗期间VTE患者的用药方法见表 3。
当PTE患者肾功能正常或合并轻度肾功能不全[肌酐清除率(CrCl)≥30 mL/min]时,推荐使用直接口服抗凝剂作为首选治疗方案。对于中度至重度肾功能不全(CrCl<30 mL/min)时,通常不推荐使用直接口服抗凝剂,应考虑使用华法林或者UFH进行抗凝治疗[10]。
推荐意见3:对于过度肥胖、低体重和妊娠期的PTE患者,在使用LMWH抗凝时,建议监测抗Ⅹa因子活性,并根据监测结果调整药物剂量。(推荐等级:Ⅱ级)
推荐意见4:建议UFH抗凝的PTE患者,依据24 h内的APTT值调整给药剂量,若24 h内APTT不能控制在1.5~3.0倍基础值之内,建议检查AT活性并依据抗Ⅹa因子活性调整剂量。(推荐等级:Ⅰ级)
推荐意见5:推荐在PTE患者使用维生素K拮抗剂(华法林)抗凝时,依据INR值指导华法林剂量的调整,宜控制INR在目标范围2~3之间。(推荐等级:Ⅱ级)
4.3 出凝血功能检测在治疗决策中的应用肝素低反应性是UFH给药剂量增加后APTT未相应延长的现象,依据发生机制可以分为AT介导的和非AT介导的。AT介导的肝素抵抗又分为遗传性AT缺乏和获得性AT缺乏。遗传性AT缺乏患者,AT活性可降至健康水平的40%~60%甚至更低,并导致VTE风险增加[55]。而获得性AT缺乏是由AT合成减少、清除增加或者血栓形成的消耗等所致。当血浆AT活性 > 80%,UFH才能发挥正常抗凝功能,APTT可有效监测;当AT活性为50%~60%时,UFH抗凝效果减低,APTT与UFH的相关性显著降低;当AT活性 < 30%时,UFH无法发挥抗凝效果,且与APTT间基本无相关性。依据相关的指南[56],在PTE的肝素抗凝治疗中,必须了解AT的活性水平。同时,还有资料[57]显示对于肝素低反应性的危重症患者应更换比伐卢定及或阿加曲班。
HIT是在应用UFH或LMWH的过程中出现的以血小板计数降低及栓塞事件等并发症为主要表现的临床综合征[58]。HIT通常发生在应用肝素后5~14 d,血小板减少发生率为85%~90% [28, 52],UFH比LMWH更易诱发HIT。在运用UFH的4~14 d(或者UFH停药前)持续监测血小板计数,每2~3 d监测一次。相关共识界定中国成人血小板减少症的定义为血小板计数<100×109/L[28]。4Ts评分系统是评估HIT可能性的重要工具[52],该系统根据血小板减少的程度、时间、血栓并发症的存在以及其他可能的原因进行评分,以预测HIT的可能性。4Ts评分:低度可能(0~3分)、中度可能(4~5分)和高度可能(6~8分)[59]。对于HIT高度可能的患者,若血小板计数下降超过基础值的50%或出现动静脉血栓应立即停用,改为非肝素类抗凝类药物治疗,包括阿加曲班、比伐卢定和磺达肝癸钠[49]。HIT诊断标准[49, 60-61]包括:肝素持续使用或近期有应用史;血小板计数下降≥30%,伴或不伴新发血栓;HIT-AbPF4-H≥1.0 U/mL。资料显示[60]:若HIT-AbPF4-H水平在1.0~1.9 U/mL之间(轻度可疑),且出现新发血栓或D-Dimer和/或TAT持续升高,则应停用肝素,改用阿加曲班,每日监测D-Dimer和TAT,3 d后复查HIT-AbPF4-H;若结果持续升高且伴有血栓,则诊断为HIT,启动替代抗凝治疗;若结果无变化或下降,则按原方案治疗。若HIT-AbPF4-H水平在2.0~3.9 U/mL之间(中度可疑),应立即停用所有肝素,评估凝血状态(血栓弹力图、D-Dimer和TAT),并根据结果制定抗凝方案;3 d后复查HIT-AbPF4-H。HIT-AbPF4-H水平≥4.0 U/mL为高度可疑,应立即停用肝素并启动替代抗凝治疗。相关指南推荐[52],对于高度可疑或确诊的HIT患者,在血小板计数恢复正常(一般为150×109/L)前,不建议应用维生素K拮抗剂。HIT合并肾功能不全的患者,推荐阿加曲班;血小板恢复正常后,可转为华法林或其他直接口服抗凝剂[52]。
易栓症是指因各种遗传性或获得性因素导致容易发生血栓形成和血栓栓塞的病理状态。PC和(或)PS缺乏是易栓症的常见原因之一。证据显示,中青年无明显诱因的反复发作性VTE及PTE,应考虑先天性易栓症可能性,血浆PC和(或)PS浓度及活性检测具有重要的诊断和治疗意义[62]。有研究显示,存在PC和(或)PS缺陷的患者应用华法林抗凝,有发生栓塞性皮肤坏死的可能,尤其在抗凝早期[56, 63]。建议合并PC和(或)PS缺乏的患者,抗凝药物选择需要个体化评估;可选择直接口服抗凝剂。对于应用华法林作为初始抗凝治疗的患者,在抗凝治疗的早期阶段,特别是在INR未达到目标值之前,需要和低分子肝素重叠应用。整体而言,PTE的治疗策略需综合考虑患者的临床表现、风险因素和治疗反应,以获得最佳的治疗效果并保证患者安全。
推荐意见6:在PTE患者应用普通肝素抗凝期间未达到抗凝效果时,应考虑AT活性缺乏的情况,建议进行AT活性检测。(推荐等级:Ⅱ级)
推荐意见7:在PTE患者中应用UFH或LMWH进行抗凝时,需关注血小板计数、凝血功能和血小板功能等相关指标监测,警惕HIT的发生。(推荐等级:Ⅱ级)
推荐意见8:中青年无明显诱因的反复发作性VTE及PTE患者,应考虑先天性易栓症的可能性,重视先天易栓因素的相关筛查。(推荐等级:Ⅱ级)
4.4 出凝血功能检测在出血管理中的应用PTE合并活动性出血是临床实践中经常遇到的问题,出血的严重程度与溶栓、抗凝决策密切相关。证据提示,在中高危和高危PTE患者中,所有治疗方式都会不同程度上导致出血风险[64]。且与单独的抗凝治疗相比,导管溶栓术(catheter directed thrombolysis, CDT)与较低的病死率相关,但出血风险更高[65]。目前公认的、由6个变量组成的VTE-BLEED评分被用于接受华法林或者达比加群等口服抗凝剂的VTE患者发生大出血的风险预测[66],该评分采用低-高风险二元分类,变量包括:活动性肿瘤(2分)、血压未控制男性(1分)、贫血(1.5分)、出血史(1.5分)、肾功能障碍[肌酐清除率30~60 mL/min](1.5分)、年龄≥60岁(1.5分),低风险为0~2分,高风险≥2分。面对PTE高出血风险的患者,有效的出血管理策略是确保患者安全和治疗效果的关键。在有效控制活动性出血的同时,需权衡治疗获益与风险,并确定启动抗凝治疗的最佳时机。国际血栓与止血学会科学与标准化委员会根据非手术研究中的主要出血定义,将活动性出血分为大出血、临床相关非大出血和小出血3个等级(表 4)[28, 67]。
| 活动性出血 | 具体表现 |
| 大出血 | (1)致死性出血;(2)某些重要部位或器官的出血,如颅内、脊柱内、腹膜后、关节内、心包等,及因出血引起的骨筋膜室综合征;(3)出血导致血流动力学不稳定,和(或)在24~48 h内引起血红蛋白水平下降20 g/L以上,或需要输至少2个单位全血或红细胞;(4)手术部位出血需要再次进行切开,关节镜或血管内介入等,或关节腔内出血致活动或伤口恢复推迟,使住院时间延长或伤口加深 |
| 临床相关非大出血 | (1)自发性皮肤出血面积 > 25 cm2;(2)自发性鼻出血时间 > 5 min;(3)持续24 h肉眼血尿;(4)便血(厕纸可见出血点);(5)牙龈出血时间 > 5 min;(6)因出血住院治疗;(7)出血需要输血但少于2个单位;(8)观察者认为影响临床治疗 |
| 小出血 | 其他类型的出血 |
活动性出血是PTE治疗中需要特别警惕的禁忌情况,一旦发生,应先评估出血程度,并据此调整治疗策略。出凝血功能的持续监测,不仅能调整药物剂量、优化治疗效果以及预防PTE患者出院后血栓复发,而且能有效降低出血风险[68]。中国医师协会介入医师分会[69],中华医学会心血管病学分会[19]、中国静脉介入联盟[42]以及美国PERT[31]发布的共识指出,对合并活动性出血的PTE患者,建议每12 h检测一次血常规、APTT、INR、FIB和D-Dimer等。特别要注意的是,对于高出血风险的PTE患者,当APTT超过基础值的3倍时以及血小板计数<80×109/L或较基础值降低>20%时,提示出血风险增高,应该停用抗凝药并密切监测[42]。此外,相关指南建议,对于无诱因复发性PTE患者,应长期甚至无限期抗凝治疗[43]。在长期管理中,推荐医疗机构提供快速、便捷的出凝血功能检测服务,需要监测的关键凝血指标包括PT、APTT、FIB、TT、D-Dimer、FDP和AT等。检测频率应根据患者的具体情况个性化调整。
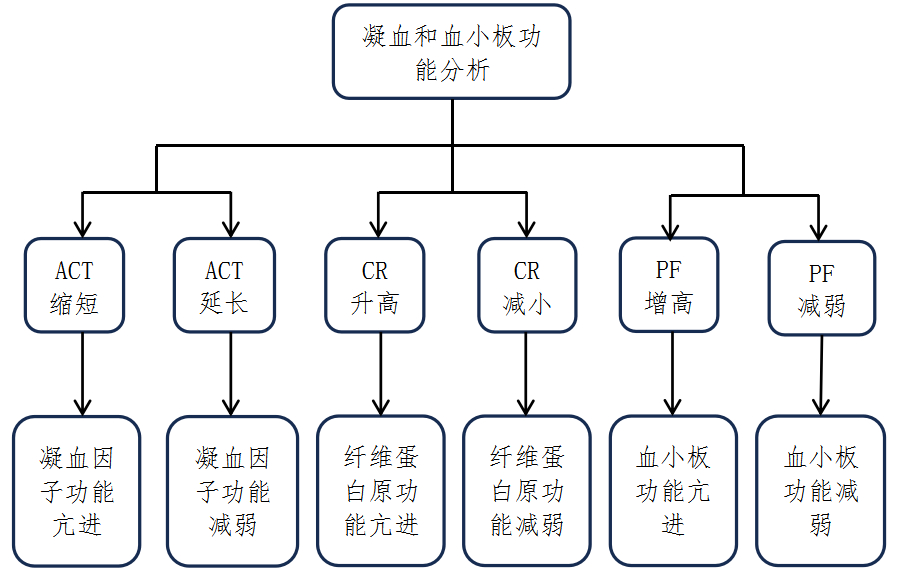
床旁检测(point-of-care testing, POCT)技术,如血栓粘弹性(viscoelastic haemostatic assay, VHA)检测,可快速提供血栓形成全过程信息,辅助分析出血原因,实现个体化凝血监测并预测PTE复发风险[70-71]。凝血和血小板功能分析仪(coagulation and platelet function analyzer, CPA)用于VHA即时检测,可以监测活化凝血时间(activated coagulation time, ACT),凝血速率(clot rate,CR)和血小板功能(platelet function, PF)。2023年《床旁血液黏弹性检测围术期应用专家共识》指出[71],应用CPA进行VHA检测时,获得的ACT、CR和PF指标可预测患者术后出血风险。CPA凝血紊乱评估流程如图 1所示[72]。鉴于PTE患者发病急、风险高,紧急情况下快速出具检测报告至关重要,建议使用轻巧、可续航的凝血检测分析仪。为优化检测流程、降低成本并提高效率,临床及社区推荐使用“单人份可多项组合检测试剂”和“全自动加样检测设备”,以减少人为误差并降低成本。总之,PTE患者凝血监测应基于充分评估,结合POCT技术选择合适的监测手段进行动态管理。
推荐意见9:在PTE患者治疗过程中应该警惕出血事件,建议密切关注出凝血指标,包括血常规、APTT、INR、FIB和D-Dimer等。(推荐等级:Ⅱ级)
5 出凝血功能检测在PTE护理实践中的应用PTE患者的凝血状态通常处于动态变化中,抗凝治疗和溶栓治疗的不同阶段需要对凝血功能进行不同频次的监测。护理人员需要密切配合医生准确采集出凝血检测标本,确保每次检测能够准确反映患者的凝血状态,从而制定个性化的护理干预方案。
5.1 出凝血功能检测标本的规范采集采血前应确保患者做好充分准备:确保患者空腹,以减少因食物影响凝血因子的活性变化;采血前避免剧烈运动或情绪波动,以降低内源性凝血因子波动;评估患者用药情况,记录是否服用抗凝药物和抗血小板药物[73],并根据临床需要调整采样时间。护士应选择合适的血液采集器具:根据釆血量、患者年龄以及静脉粗细程度选用不同型号的穿刺针头;成人宜使用19~21 G的穿刺针头,对于新生儿、儿童或静脉较细的成人宜使用22~23 G穿刺针头;推荐使用加入抗凝剂的真空采血管采集[74]。
进行采血操作时,应严格遵循规范,以避免采集过程中可能引起的技术性偏差。选择合适的静脉是保证血样质量的关键。优先选择肘正中静脉,其次可选贵要静脉或头静脉[75]。止血带的使用应严格控制在1 min以内,以避免血液浓缩并影响凝血因子的活性。同一患者需采集多管血液检测标本时,采血顺序应遵循标准操作流程,依次采集血培养管(无抗凝剂)、柠檬酸钠抗凝管(用于凝血功能检测)、血常规管(EDTA抗凝)、以及生化和免疫检测管(血清管)。使用蝶翼针且仅采集枸橼酸钠抗凝标本时,宜弃去第一支采血管(被弃去的第一支采血管的血液用于预充采血组件的管路)。应尽可能避免通过肝素流过的管路釆集血液,如不得不通过血管通路装置采血(vascular access device, VAD)时:应考虑到可能存在的肝素污染和标本稀释;该情形下,宜使用5 mL生理盐水冲洗管路,冲洗后最初釆集的5 mL血液或者6倍VAD死腔容积的标本不能用于出凝血功能检测;应仔细检查血液采集系统各个部件(连接装置、注射器、针和釆集器具)的匹配性,以免因漏气可能导致的溶血和采血量不准确;同时须在送检标本上注明采血方式以便临床医生参考[74, 76]。
采集后的标本应将试管轻柔颠倒混匀3~6次,或参照制造商推荐的混匀方法和次数。过度混匀可能造成溶血和/或血小板激活,导致结果出错。止血功能异常的患者拔出采血针后,按压穿刺点应大于5 min。标本釆集后应尽可能减少运送环节并缩短运送时间,应在2 h内送检,标本的运送应由经培训的专人负责且有制度约束。医院内部标本采集后宜在18 ℃~24 ℃条件下运送至实验室,不能冷藏[74, 77]。
5.2 出凝血功能检测标本的质量控制凝血功能检测的准确性受到多种因素的影响,主要包括血液稀释或浓缩、溶血及标本运输不当等。血液稀释或浓缩可能由于止血带使用过久或抗凝剂比例错误,导致PT、APTT等指标的偏差。溶血则可能由于负压过大、反复穿刺或标本剧烈振荡引起红细胞破裂,从而影响凝血功能检测的结果。此外,标本运输过程中温度控制不当也可能影响检测结果,低温可能导致凝血因子活性降低,而高温则可能引起纤维蛋白原降解。
为确保凝血功能检测结果的准确性,应定期对采血操作人员开展专业培训,确保其全面掌握标准操作流程及技术要求。培训内容应包括标本采集技巧、标本保存条件、潜在干扰因素的识别与规避,确保操作人员能够有效防止常见误操作。此外,应根据实际情况定期对操作人员进行考核,确保其操作技能持续符合出凝血标本采集需求。
同时,建议成立专门管理小组,定期整理与分析不合格标本数据,并在护理部与检验科的协作下,定期组织质量管理沟通会议,开展标准化的风险评估。通过对耗材储存、血液采集、标本运输、预处理和标本质量等各环节进行临床追踪,持续优化标本质量管理流程,从而不断提升出凝血功能检测结果的准确性及整体医疗安全水平[78]。
推荐意见10:在PTE患者的护理过程中,除了密切监测出凝血指标外,推荐严格按照规范正确采集出凝血检测标本,以确保检测结果的准确性。(推荐等级:Ⅱ级)
6 出凝血功能检测的标准化为确保PTE全流程出凝血检测的标准化,急诊、重症监护及社区医疗机构等各环节应严格遵循行业标准。从分级诊疗的角度而言,急诊与重症监护及社区医疗机构的出凝血检测应该在检验实验室完成,社区医疗的检验应该在社区医疗机构完成,为保障PTE肺栓塞全流程检测结果持续地精准稳定,社区医疗机构的出凝血检测结果应该可与急诊、重症监护所在医疗机构检验实验室结果互认。依据《凝血因子活性测定技术标准》(WS/T 220-2021)[79]和2020年《世界卫生组织血友病管理指南,第三版》[80],实施全面质量管理,包括室内质控(Internal Quality Control, IQC)、外部质量评估(External Quality Assessment, EQA),以确保凝血因子活性测定的准确性和可靠性。专家组确定了凝血功能检测方法准确性评估的关键要素。
6.1 方法学统一社区医疗机构应采用与急诊和重症医疗单位临床实验室相同的方法学检测凝血功能,确保检测结果的一致性和准确性。依据凝血瀑布学说[81],推荐使用凝固法、免疫比浊法和发色底物法等标准方法进行止凝血功能检测。
6.2 质控统一社区医疗机构应遵循与专业实验室同等严格的质控标准,包括使用标准化质控品及多规则质控管理措施,确保检测结果的准确性和可靠性。
6.3 标本采集统一血液标本的采集和处理应严格遵循国家行业标准《凝血试验样本采集标准》[82]和《血栓与止血检验常用项目的标本采集与处理(发布稿)》[74],避免样本质量问题导致结果偏差。为满足凝血检测前的质量控制要求,凝血采用血浆,血小板采用全血样本,建议使用可“原始管上机”检测的血浆或者全血标本,并采用凝血分析仪进行检测。
6.4 各级检验科或中心实验室间结果互认凝血检测结果的精准性和稳定性对于PTE的诊断至关重要。为确保社区医疗机构的检测结果与急诊、重症监护机构结果互认,需严格管理质量控制、实验室间结果互认、抗凝治疗及转诊流程。《临床血液学(凝血)检验常用项目分析质量标准》(WS/T406—2024)[83]设定了实验室结果相对偏差的界限。建议使用具备IQC和室间质评(卫生部临检中心、各省临检中心、不同省份检验结果互认)功能的全自动化凝血分析仪,以实现不同实验室间结果的互认,确保高标准和一致性。表 5列出了与PTE诊断、治疗和管理相关的关键凝血指标的参考值及其临床意义。
| 凝血指标 | 正常参考值 | 延长/升高临床意义 | 缩短/降低临床意义 |
| PT | 11.5~14.5 s | 延长 > 3 s,纤溶亢进,抗凝阶段,存在出血风险 | 血栓前状态 |
| INR | 0.8~1.2 | 抗凝阶段,>3时存在出血风险 | 血栓形成状态 |
| APTT | 20~40 s | 延长 > 10 s,抗凝阶段,存在出血风险 | 血栓形成及血液呈高凝状态 |
| TT | 11~14 s | 延长 > 3 s,AT升高,FDP/D-Dimer增多,抗凝阶段,存在出血风险 | 存在微小凝块,可以粗略用于检测肝素抗凝治疗 |
| FIB | 2~4 g/L | 血栓高凝状态 | <1.5 g/L,低凝血期及纤溶期,溶栓治疗的监测,存在出血风险 |
| FDP | 0-5 mg/L | 原发性纤溶亢进,血栓高凝状态 | - |
| D-Dimer | < 500 μg/L | 继发性纤溶亢进,血栓高凝状态,提示发生PTE的风险增加 | 对于低可能性的患者,可基本排除PTE |
| AT | 80%~120% | 血液抗凝活性增强 | 血栓形成状态,抗凝能力下降及肝素抗凝作用减弱 |
| 血小板计数 | (125~320)×109个/L | 血小板易发生黏附、聚集及释放反应,可能形成血小板性血栓 | < 100×109个/L,出血风险增加 |
| PC | 70%~140% | 病理性异常 | 易形成血栓 |
| PS | 63.5%~149% | 病理性异常 | 易形成血栓 |
总之,出凝血功能检测在PTE的诊治以及预后管理中起重要作用,它不仅是PTE确诊的关键辅助手段,也是制定和调整治疗方案、预防出血并发症以及指导出院后管理的重要依据。准确、及时的凝血指标监测有助于实现个体化治疗,降低血栓复发风险及出血等不良事件发生率。本共识基于科学证据,为各级医疗机构提供关于PTE诊疗中凝血功能指标检测的指导和实践性参考。
共识执笔:米玉红(首都医科大学附属北京安贞医院)文洪林(首都医科大学附属北京中医医院)裴晓璐(首都医科大学附属北京中医医院)
专家组成员(按姓名汉语拼音为序):曹英娟(山东大学齐鲁医院)陈飙(华中科技大学同济医学院附属协和医院)陈楚(陕西省中医医院)陈分乔(河北省中医院)陈旭锋(江苏省人民医院)迟骋(北京大学人民医院)崇巍(中国医科大学附属第一医院)丛云峰(哈尔滨医科大学附属第四医院)党星波(陕西省人民医院)丁邦晗(广东省中医院)杜俊艳(北京中医医院内蒙古医院)段培蓓(南京中医药大学附属医院)樊麦英(湖南省人民医院(湖南师范大学附属第一医院)范粉灵(西安交通大学一附院)顾伟(清华大学附属垂杨柳医院)郭伟(首都医科大学附属北京中医医院)郭杨(北京大学人民医院)郇霞(西藏山南市人民医院)纪玲(北京大学深圳医院)康熙雄(首都医科大学附属北京天坛医院)李芳(广东省中医院)李凤杰(首都医科大学附属北京潞河医院)李杰(首都医科大学附属复兴医院)李莉(上海临床研究中心)李琦(沈阳医学院附属中心医院)李文放(上海长征医院)李晓晶(北京大学第一医院)李岩(首都医科大学附属北京友谊医院)利定建(阳江市人民医院)梁永辉(北京大学航天临床医学院)刘波(首都医科大学附属北京佑安医院)刘彭(乌鲁木齐市第一人民医院)刘姝(河南中医药大学第一附属医院)刘香弟(北京中医药大学护理学院)刘志(首都医科大学宣武医院)陆松松(北京大学人民医院)栾伟(上海中医药大学附属曙光医院)马丽芳(首都医科大学附属北京中医医院)马岳峰(浙江大学医学院附属第二医院)米玉红(首都医科大学附属北京安贞医院)庞鸿垠(吉林省四平市中心人民医院)裴俏(中国急救医学编辑部)裴晓璐(首都医科大学附属北京中医医院)寿松涛(天津医科大学总医院)宋鉴清(中国医科大学附属第一医院)孙朝晖(中国人民解放军南部战区总医院)唐艳(兰州市第三人民医院)滕玥(北部战区总医院)万钧(首都医科大学附属北京安贞医院)王大光(航空总医院)王军宇(首都医科大学附属北京朝阳医院)王学锋(上海交通大学医学院附属瑞金医院)魏琳(广东省中医院)文洪林(首都医科大学附属北京中医医院)吴彩军(北京中医药大学东直门医院)吴卫(北京协和医院)伍宏泽(江西省九江市中医医院)徐玢(首都医科大学附属北京天坛医院)徐红日(北京中医药大学第三附属医院)许慧(应急总医院)晏玲丽(拉萨市人民医院)燕宪亮(徐州医科大学附属医院)杨冬梅(大穷油田总医院)杨芳宇(首都医科大学)杨军(武汉亚洲心脏病医院)杨媛华(首都医科大学附属北京朝阳医院)殷文朋(首都医科大学附属北京朝阳医院)尹明(解放军总医院第二医学中心)于波海(广州中医药大学深圳医院(福田))余涛(中山大学孙逸仙纪念医院)喻容(湖南中医药大学第二附属医院)岳树锦(北京中医药大学护理学院)张健(北京市大兴区人民医院)张蕾(北京安贞医院)张斯龙(中华急诊医学杂志)张天鹏(首都医科大学附属北京友谊医院)张瑛琪(河北医科大学第三医院)赵斌(北京积水潭医院)赵虎(复旦大学附属华东医院)赵丽新(首都医科大学附属北京朝阳医院)赵利强(吉林省辽源市中心医院)郑玉亭(漳州市长泰区医院)朱海燕(解放军总医院第一医学中心)
利益冲突 所有作者声明无利益冲突
| [1] | Huisman MV, Barco S, Cannegieter SC, et al. Pulmonary embolism[J]. Nat Rev Dis Primers, 2018, 4: 18028. DOI:10.1038/nrdp.2018.28 |
| [2] | Lutsey PL, Zakai NA. Epidemiology and prevention of venous thromboembolism[J]. Nat Rev Cardiol, 2023, 20(4): 248-262. DOI:10.1038/s41569-022-00787-6 |
| [3] | Cao YS, Geng C, Li YH, et al. In situ pulmonary artery thrombosis: a previously overlooked disease[J]. Front Pharmacol, 2021, 12: 671589. DOI:10.3389/fphar.2021.671589 |
| [4] | Konstantinides SV, Wärntges S. Acute phase treatment of venous thromboembolism: advanced therapy[J]. Thromb Haemost, 2015, 113(6): 1202-1209. DOI:10.1160/TH14-11-0998 |
| [5] | Diamond IR, Grant RC, Feldman BM, et al. Defining consensus: a systematic review recommends methodologic criteria for reporting of Delphi studies[J]. J Clin Epidemiol, 2014, 67(4): 401-409. DOI:10.1016/j.jclinepi.2013.12.002 |
| [6] | Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and stroke statistics-2021 update: a report from the American heart association[J]. Circulation, 2021, 143(8): e254-e743. DOI:10.1161/CIR.0000000000000950 |
| [7] | Martin SS, Aday AW, Almarzooq ZI, et al. 2024 heart disease and stroke statistics: a report of US and global data from the American heart association[J]. Circulation, 2024, 149(8): e347-e913. DOI:10.1161/CIR.0000000000001209 |
| [8] | Zhang Z, Lei JP, Shao X, et al. Trends in hospitalization and in-hospital mortality from VTE, 2007 to 2016, in China[J]. Chest, 2019, 155(2): 342-353. DOI:10.1016/j.chest.2018.10.040 |
| [9] | Essien EO, Rali P, Mathai SC. Pulmonary embolism[J]. Med Clin N Am, 2019, 103(3): 549-564. DOI:10.1016/j.mcna.2018.12.013 |
| [10] | Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS)[J]. Eur Heart J, 2020, 41(4): 543-603. DOI:10.1093/eurheartj/ehz405 |
| [11] | Zhai ZG, Wang DY, Lei JP, et al. Trends in risk stratification, in-hospital management and mortality of patients with acute pulmonary embolism: an analysis from the China pUlmonary thromboembolism REgistry Study (CURES)[J]. Eur Respir J, 2021, 58(4): 2002963. DOI:10.1183/13993003.02963-2020 |
| [12] | Morrone D, Morrone V. Acute pulmonary embolism: focus on the clinical picture[J]. Korean Circ J, 2018, 48(5): 365-381. DOI:10.4070/kcj.2017.0314 |
| [13] | 陈升汶, 黄平. 实用急性肺栓塞诊疗手册[M]. 北京: 人民卫生出版社, 2016. |
| [14] | Sharma GV, McIntyre KM, Sharma S, et al. Clinical and hemodynamic correlates in pulmonary embolism[J]. Clin Chest Med, 1984, 5(3): 421-437. DOI:10.1016/S0272-5231(21)00267-7 |
| [15] | Konstantinides SV, Meyer G. The 2019 ESC guidelines on the diagnosis and management of acute pulmonary embolism[J]. Eur Heart J, 2019, 40(42): 3453-3455. DOI:10.1093/eurheartj/ehz726 |
| [16] | Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer[J]. Thromb Haemost, 2000, 83(3): 416-420. DOI:10.1055/s-0037-1613830 |
| [17] | Gal GL, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score[J]. Ann Intern Med, 2006, 144(3): 165-171. DOI:10.7326/0003-4819-144-3-200602070-00004 |
| [18] | Koziatek CA, Simon E, Horwitz LI, et al. Automated pulmonary embolism risk classification and guideline adherence for computed tomography pulmonary angiography ordering[J]. Acad Emerg Med, 2018, 25(9): 1053-1061. DOI:10.1111/acem.13442 |
| [19] | 中华医学会心血管病学分会, 中国医师协会心血管内科医师分会肺血管疾病学组, 中国肺栓塞救治团队(PERT)联盟. 急性肺栓塞多学科团队救治中国专家共识[J]. 中华心血管病杂志, 2022, 50(1): 25-35. DOI:10.3760/cma.j.cn112148-20210527-00455 |
| [20] | Kline JA, Jimenez D, Mark Courtney D, et al. Comparison of four bleeding risk scores to identify rivaroxaban-treated patients with venous thromboembolism at low risk for major bleeding[J]. Acad Emerg Med, 2016, 23(2): 144-150. DOI:10.1111/acem.12865 |
| [21] | 唐慧琴, 王伟鑫, 于宝丹, 等. 血栓弹力图联合凝血功能指标在肺血栓栓塞症患者中的应用研究[J]. 检验医学与临床, 2022, 19(8): 1118-1121. DOI:10.3969/j.issn.1672-9455.2022.08.028 |
| [22] | Wu YY, Tan Y, Yan M, et al. Analysis of CRP, antithrombin, fibrinogen, and hematological changes in 433 patients with PTE[J]. Int J Gen Med, 2021, 14: 7181-7185. DOI:10.2147/IJGM.S333747 |
| [23] | Shi MJ, Gao WB, Jin YB, et al. Antiphospholipid syndrome-related pulmonary embolism: clinical characteristics and early recognition[J]. Front Cardiovasc Med, 2022, 9: 872523. DOI:10.3389/fcvm.2022.872523 |
| [24] | Zhou Q, Huang RC, Xiong XY, et al. Prediction of pulmonary embolism by an explainable machine learning approach in the real world[J]. Sci Rep, 2025, 15(1): 835. DOI:10.1038/s41598-024-75435-9 |
| [25] | Yang CG, Zhu LM. Coagulation and deep vein flow changes following laparoscopic total extraperitoneal inguinal hernia repair: a single-center, prospective cohort study[J]. Surg Endosc, 2019, 33(12): 4057-4065. DOI:10.1007/s00464-019-06700-6 |
| [26] | Tian B, Song CF, Li H, et al. The significance of perioperative coagulation and fibrinolysis related parameters after lung surgery for predicting venous thromboembolism: a prospective, single center study[J]. J Thorac Dis, 2018, 10(4): 2223-2230. DOI:10.21037/jtd.2018.03.174 |
| [27] | Ben SQ, Ni SS, Shen HH, et al. The dynamic changes of LDH isoenzyme 3 and D-dimer following pulmonary thromboembolism in canine[J]. Thromb Res, 2007, 120(4): 575-583. DOI:10.1016/j.thromres.2006.12.015 |
| [28] | 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14): 1060-1087. DOI:10.3760/cma.j.issn.0376-2491.2018.14.007 |
| [29] | 中国研究型医院学会血栓与止血专业委员会. D-二聚体实验室检测与临床应用中国专家共识[J]. 中华医学杂志, 2023, 103(35): 2743-2756. DOI:10.3760/cma.j.cn112137-20230721-00066 |
| [30] | Bass AR, Fields KG, Goto R, et al. Clinical decision rules for pulmonary embolism in hospitalized patients: a systematic literature review and Meta-analysis[J]. Thromb Haemost, 2017, 117(11): 2176-2185. DOI:10.1160/TH17-06-0395 |
| [31] | Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium[J]. Clin Appl Thromb Hemost, 2019, 25: 1076029619853037. DOI:10.1177/1076029619853037 |
| [32] | Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study[J]. JAMA, 2014, 311(11): 1117-1124. DOI:10.1001/jama.2014.2135 |
| [33] | Fuchs E, Asakly S, Karban A, et al. Age-adjusted cutoff D-dimer level to rule out acute pulmonary embolism: a validation cohort study[J]. Am J Med, 2016, 129(8): 872-878. DOI:10.1016/j.amjmed.2016.02.043 |
| [34] | Penaloza A, Roy PM, Kline J, et al. Performance of age-adjusted D-dimer cut-off to rule out pulmonary embolism[J]. J Thromb Haemost, 2012, 10(7): 1291-1296. DOI:10.1111/j.1538-7836.2012.04769.x |
| [35] | Lozano-Polo L, Puig-Campmany M, Herrera-Mateo S, et al. Diagnosis of pulmonary embolism in the elderly: adherence to guidelines and age-adjusted D-dimer concentration values[J]. Emergencias, 2018, 30(5): 321-327. |
| [36] | Liu P, Yu HX, Liu W, et al. Distinct age-adjusted D-dimer threshold to rule out acute pulmonary embolism in outpatients and inpatients[J]. Clin Respir J, 2024, 18(2): e13728. DOI:10.1111/crj.13728 |
| [37] | 夏书月. 急性肺血栓栓塞症的规范化抗凝和溶栓治疗[J]. 中国实用内科杂志, 2021, 41(6): 501-507. DOI:10.19538/j.nk2021060111 |
| [38] | Stewart LK, Kline JA. Fibrinolytics for the treatment of pulmonary embolism[J]. Transl Res, 2020, 225: 82-94. DOI:10.1016/j.trsl.2020.05.003 |
| [39] | Powers WJ, Rabinstein AA, Ackerson T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American heart association/American stroke association[J]. Stroke, 2019, 50(12): e344-e418. DOI:10.1161/STR.0000000000000211 |
| [40] | Berge E, Whiteley W, Audebert H, et al. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke[J]. Eur Stroke J, 2021, 6(1): I-LXII. DOI:10.1177/2396987321989865 |
| [41] | 中华医学会呼吸病学分会, 王辰. 肺血栓栓塞症的诊断与治疗指南(草案)[J]. 中华医学会呼吸病学分会, 2001, 24(05): 259-264. |
| [42] | 中国静脉介入联盟, 中国医师协会介入医师分会外周血管介入专业委员会, 国际血管联盟中国分部护理专业委员会. 致命性肺血栓栓塞症急救护理专家共识[J]. 中华现代护理杂志, 2023, 29(17): 2241-2250. DOI:10.3760/cma.j.cn115682-20221115-05533 |
| [43] | Ortel TL, Neumann I, Ageno W, et al. American Society of Hematology 2020 guidelines for management of venous thromboembolism: treatment of deep vein thrombosis and pulmonary embolism[J]. Blood Adv, 2020, 4(19): 4693-4738. DOI:10.1182/bloodadvances.2020001830 |
| [44] | Favaloro EJ, Kershaw G, Mohammed S, et al. How to optimize activated partial thromboplastin time (APTT) testing: solutions to establishing and verifying normal reference intervals and assessing APTT reagents for sensitivity to heparin, lupus anticoagulant, and clotting factors[J]. Semin Thromb Hemost, 2019, 45(1): 22-35. DOI:10.1055/s-0038-1677018 |
| [45] | Pineo GF, Hull RD. Prevention and treatment of venous thromboembolism[J]. Drugs, 1996, 52(1): 71-92. DOI:10.2165/00003495-199652010-00006 |
| [46] | Raschke RA, Reilly BM, Guidry JR, et al. The weight-based heparin dosing nomogram compared with a standard care nomogram[J]. Ann Intern Med, 1993, 119(9): 874-881. DOI:10.7326/0003-4819-119-9-199311010-00002 |
| [47] | Hull RD, Raskob GE, Rosenbloom D, et al. Optimal therapeutic level of heparin therapy in patients with venous thrombosis[J]. Arch Intern Med, 1992, 152(8): 1589-1595. DOI:10.1001/archinte.1992.00400200027006 |
| [48] | Kearon C, Akl EA, Comerota AJ, et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th Ed: American college of chest physicians evidence-based clinical practice guidelines[J]. Chest, 2012, 141(2 Suppl): e419S-e496S. DOI:10.1378/chest.11-2301 |
| [49] | 中国医师协会心血管内科医师分会血栓防治专业委员会, 《中华医学杂志》编辑委员会. 肝素诱导的血小板减少症中国专家共识(2017)[J]. 中华医学杂志, 2018, 98(6): 408-417. DOI:10.3760/cma.j.issn.0376-2491.2018.06.003 |
| [50] | Ridker PM, Goldhaber SZ, Danielson E, et al. Long-term, low-intensity warfarin therapy for the prevention of recurrent venous thromboembolism[J]. N Engl J Med, 2003, 348(15): 1425-1434. DOI:10.1056/NEJMoa035029 |
| [51] | 中华医学会心血管病学分会, 中国老年学学会心脑血管病专业委员会. 华法林抗凝治疗的中国专家共识[J]. 中华内科杂志, 2013, 52(1): 76-82. DOI:10.3760/cma.j.issn.0578-1426.2013.01.027 |
| [52] | Cuker A, Arepally GM, Chong BH, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia[J]. Blood Adv, 2018, 2(22): 3360-3392. DOI:10.1182/bloodadvances.2018024489 |
| [53] | 彭文星. 口服抗凝药物治疗管理路径专家共识[J]. 临床药物治疗杂志, 2024, 22(9): 1-23. DOI:10.3969/j.issn.1672-3384.2024.09.001 |
| [54] | Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies[J]. BMJ, 2020, 370: m2177. DOI:10.1136/bmj.m2177 |
| [55] | Patnaik MM, Moll S. Inherited antithrombin deficiency: a review[J]. Haemophilia, 2008, 14(6): 1229-1239. DOI:10.1111/j.1365-2516.2008.01830.x |
| [56] | 中华医学会血液学分会血栓与止血学组. 易栓症诊断与防治中国指南(2021年版)[J]. 中华血液学杂志, 2021, 42(11): 881-888. DOI:10.3760/cma.j.issn.0253-2727.2021.11.001 |
| [57] | 门剑龙, 徐菲亚, 翟振国. 肝素抵抗的发生机制及临床处理策略[J]. 中华医学杂志, 2023, 103(10): 707-713. DOI:10.3760/cma.j.cn112137-20220830-01838 |
| [58] | Koster A, Nagler M, Erdoes G, et al. Heparin-induced thrombocytopenia: perioperative diagnosis and management[J]. Anesthesiology, 2022, 136(2): 336-344. DOI:10.1097/ALN.0000000000004090 |
| [59] | Pouplard C, Gueret P, Fouassier M, et al. Prospective evaluation of the '4Ts' score and particle gel immunoassay specific to heparin/PF4 for the diagnosis of heparin-induced thrombocytopenia[J]. J Thromb Haemost, 2007, 5(7): 1373-1379. DOI:10.1111/j.1538-7836.2007.02524.x |
| [60] | 范庆坤, 张真路. 如何面对肝素诱导血小板减少症诊断的困惑[J]. 中华检验医学杂志, 2019, 42(4): 227-231. DOI:10.3760/cma.j.issn.1009-8158.2019.04.001 |
| [61] | 闫姝洁, 卞璐瑜, 滕媛, 等. 肝素诱导血小板减少症成人体外循环管理临时专家共识[J]. 中国体外循环杂志, 2024, 22(2): 82-86. DOI:10.13498/j.cnki.chin.j.ecc.2024.02.02 |
| [62] | 刘芳, 诸兰艳, 陈平, 等. 蛋白C/蛋白S缺乏症相关的肺动脉血栓栓塞症[C]. 中华医学会第六届全国肺栓塞与肺血管病学术会议暨第四届国际肺循环病研讨会论文集, 重庆, 2013: 192-193. |
| [63] | Alshehri FS, Bashmeil AA, Alamar IA, et al. The natural anticoagulant protein S; hemostatic functions and deficiency[J]. Platelets, 2024, 35(1): 2337907. DOI:10.1080/09537104.2024.2337907 |
| [64] | Patel AB, Mai V, Caiano L, et al. Fatal pulmonary embolism, fatal bleeding and intracranial hemorrhage with systemic and catheter-directed thrombolysis in intermediate-high and high-risk pulmonary embolism: a systematic review with Meta-analysis[J]. Blood, 2023, 142(Supplement 1): 2644. DOI:10.1182/blood-2023-182859 |
| [65] | Zhang RS, Maqsood MH, Sharp ASP, et al. Efficacy and safety of anticoagulation, catheter-directed thrombolysis, or systemic thrombolysis in acute pulmonary embolism[J]. JACC Cardiovasc Interv, 2023, 16(21): 2644-2651. DOI:10.1016/j.jcin.2023.07.042 |
| [66] | Klok FA, Hösel V, Clemens A, et al. Prediction of bleeding events in patients with venous thromboembolism on stable anticoagulation treatment[J]. Eur Respir J, 2016, 48(5): 1369-1376. DOI:10.1183/13993003.00280-2016 |
| [67] | Schulman S, Angerås U, Bergqvist D, et al. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients[J]. J Thromb Haemost, 2010, 8(1): 202-204. DOI:10.1111/j.1538-7836.2009.03678.x |
| [68] | Lim HY, O'Malley C, Donnan G, et al. A review of global coagulation assays: Is there a role in thrombosis risk prediction?[J]. Thromb Res, 2019, 179: 45-55. DOI:10.1016/j.thromres.2019.04.033 |
| [69] | 中国医师协会介入医师分会, 中华医学会放射学分会介入专业委员会, 中国静脉介入联盟. 下肢深静脉血栓形成介入治疗规范的专家共识(第2版)[J]. 中华介入放射学电子杂志, 2018, 6(4): 283-288. DOI:10.3877/cma.j.issn.2095-5782.2018.04.001 |
| [70] | Benes J, Zatloukal J, Kletecka J. Viscoelastic methods of blood clotting assessment - A multidisciplinary review[J]. Front Med (Lausanne), 2015, 2: 62. DOI:10.3389/fmed.2015.00062 |
| [71] | 天津市输血协会围术期输血专业委员会, 于泳浩. 床旁血液黏弹性检测围术期应用专家共识[J]. 中国中西医结合急救杂志, 2023, 30(4): 385-391. DOI:10.3969/j.issn.1008-9691.2023.04.001 |
| [72] | 中国医药教育协会发布. 团体标准-凝血障碍诊断规范T/CMEAS 019-2024[S]. 2024. |
| [73] | Schiffer S, Schwers S, Heitmeier S. The effect of rivaroxaban on biomarkers in blood and plasma: a review of preclinical and clinical evidence[J]. J Thromb Thrombolysis, 2023, 55(3): 449-463. DOI:10.1007/s11239-023-02776-z |
| [74] | 国家卫生健康委员会. 血栓与止血检验常用项目的标本采集与处理: WS/T 359-2024[S]. 2024. |
| [75] | Kitchen S, Adcock DM, Dauer R, et al. International Council for Standardization in Haematology (ICSH) recommendations for processing of blood samples for coagulation testing[J]. Int J Lab Hematol, 2021, 43(6): 1272-1283. DOI:10.1111/ijlh.13702 |
| [76] | 吴瑶瑶, 徐武敏, 黄筱燕, 等. 不同采血方法对血透半永久导管华法林抗凝者出凝血指标的影响[J]. 中华全科医学, 2016, 14(4): 643-645. DOI:10.16766/j.cnki.issn.1674-4152.2016.04.042 |
| [77] | 国家卫生健康委员会. 静脉血液标本采集指南. WS/T 661-2020. 国内-行业标准-行业标准-卫生CN-WS. |
| [78] | 不合格静脉血标本管理中国专家共识[J]. 中华检验医学杂志, 2020, 43(10): 956-963. DOI: 10.3760/cma.j.cn114452-20200615-00551. |
| [79] | 国家卫生健康委员会. 凝血因子活性测定技术标准: WS/T 220—2021[S]. 北京: 中国标准出版社, 2021. |
| [80] | Srivastava A, Santagostino E, Dougall A, et al. WFH guidelines for the management of hemophilia, 3rd edition[J]. Haemophilia, 2020, 26(Suppl 6): 1-158. DOI:10.1111/hae.14046 |
| [81] | Davie EW, Ratnoff OD. Waterfall sequence for intrinsic blood clotting[J]. Science, 1964, 145(3638): 1310-1312. DOI:10.1126/science.145.3638.1310 |
| [82] | Lippi G, Salvagno GL, Montagnana M, et al. Quality standards for sample collection in coagulation testing[J]. Semin Thromb Hemost, 2012, 38(6): 565-575. DOI:10.1055/s-0032-1315961 |
| [83] | 国家卫生健康委员会. 临床血液检验常用项目分析质量标准: WS/T 406—2024[S]. 北京: 中国标准出版社, 2024. |
 2025, Vol. 34
2025, Vol. 34