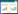肉毒中毒(botulism)是一种由革兰氏阳性厌氧菌肉毒梭状芽孢杆菌产生的肉毒神经毒素(botulinum neurotoxin,BoNT)介导的疾病。BoNT是目前已知最毒的生物毒素之一,相对分子质量为150 000,由50 000的轻链及100 000的重链组成。毒素进入生物体内后,通过受体介导的内吞作用,易位到胞浆,使参与神经递质乙酰胆碱释放的蛋白质裂解,通过抑制突触前运动神经元末端的乙酰胆碱释放,阻断乙酰胆碱在神经肌肉接头的功能,从而导致特征性的弛缓性麻痹[1]。见图 1。症状始于颅神经麻痹,并可能发展为四肢无力和呼吸衰竭。目前已鉴定出8种类型肉毒神经毒素(A、B、C、D、E、F、G和H);人类中毒以A、B及E型最常见,偶尔由F型引起[2-3],且A型中毒症状较B型重[4]。国内外常有散发或群体食源性中毒事件的报道,近年来随着BoNT临床应用的增加,出现了一些因注射BoNT中毒的患者。肉毒中毒起病比较隐匿,加上对肉毒中毒的认识不足,容易出现漏诊与误诊。基于此,中国医师协会急诊医师分会组织国内急诊专家成立编写小组,针对肉毒中毒诊疗中的关键性问题,整合国内外最新文献与临床经验,撰写专家共识初稿,经过多轮次讨论并最终定稿,形成《肉毒中毒诊治急诊专家共识》(指南共识注册编号:PREPARE-2024CN1235),旨在指导急诊各级医师早期识别与规范救治肉毒中毒。
|
| 注:①BONT的HC-C结构域(绿色球体)与突触前膜的聚唾液酸神经节脂苷(浅蓝色)受体结合,随后与突触囊泡管腔的蛋白质受体结合;②BoNT在突触小泡内内化;③开始于由ATP酶引起的囊泡腔酸化(含H+的绿色区域),通过囊泡神经递质转运体(粉色)驱动神经递质积累(深蓝点),L链的膜易位进入细胞质;④二硫化物链间键的还原作用,从HN结构域释放L;⑤BoNT-L切割囊泡膜蛋白(蓝色);SNAP-25(绿色棒状)和突触融合蛋白(绿色曲线)神经递质释放的长期抑制,从而导致神经麻痹 图 1 肉毒中毒机制 |
|
|
本共识编写组充分遵循《中国制订/修订临床诊疗指南的指导原则(2022版)》对推荐意见的证据质量和推荐等级进行分级(见表 1)。
| 证据等级与推荐等级 | 说明 |
| 证据等级 | |
| 等级Ⅰ(高等级) | 高质量的随机对照临床研究(RCT)、权威指南以及高质量系统综述和Meta分析 |
| 等级Ⅱ(中等级) | 有一定研究局限性的RCT研究(如无隐藏分组、未设盲、未报告失访)、队列研究、病例系列研究及病例对照研究 |
| 等级Ⅲ(低等级) | 病例报道、专家意见 |
| 推荐等级 | |
| A(强推荐) | 该方案大多数患者、医生和政策制定者都会采纳 |
| B(中度推荐) | 该方案多数人会采纳,但仍有部分人不采纳,要结合患者具体情况作出体现其价值观和意愿的决定 |
| C(弱推荐) | 证据不足,需要患者、医生和政策制定者共同讨论决定 |
BoNT中毒的途径主要包含以下4种:
1.1 食源性肉毒中毒美国疾病防控中心(CDC)2002—2015年期间记录到402例肉毒中毒病例,其中食源性中毒占比达到86%。我国文献报道的散发与群体中毒事件也基本是食源性中毒为主。A、B和E型毒素与食源性肉毒中毒有关。中毒食物包括已发酵或腐败的食物,如自制臭豆腐等,食用蜂蜜也有中毒的报道。食源性肉毒中毒与生产环境、储存不当及饮食习惯有关[5]。
1.2 注射性肉毒中毒随着肉毒神经毒素在医疗领域的应用不断增加,注射引起的肉毒中毒也开始显现[6-8]。
1.3 创伤性肉毒中毒是肉毒梭状芽孢杆菌产生的芽孢通过感染的伤口直接进入体内并释放毒素所致。多见于静脉毒品使用患者,也可见于擦伤、撕裂伤、开放性骨折、手术切口甚至是闭合性血肿患者[9-11]。
1.4 其他少见肉毒中毒婴儿肉毒中毒:大多发生12月龄以下,由于婴儿肠道功能未健全,在此基础上摄入肉毒梭状芽孢杆菌污染的蜂蜜、奶粉等辅食,芽孢在肠道繁殖并产生毒素入血致病[12-13]。
成人肠道定植肉毒中毒与婴儿发病类似,因摄入肉毒梭菌芽孢导致,在正常人群中少见,但当人体肠道菌群发生改变时,如腹部手术、长时间应用抗生素等情况下,可发生肠道BoNT中毒,较食源性中毒更难诊断,容易被延误诊断[14]。
吸入性肉毒中毒:吸入性肉毒中毒很罕见,由吸入释放BoNT的气溶胶所致,是一种非自然状态中毒,在实验室事故和军事生化武器应用中有描述[15]。
推荐意见1:食源性是肉毒中毒的主要途径,注射性肉毒中毒呈上升趋势。疑似肉毒中毒要重视流行病学史,特别是询问是否食用发酵或腐败的食物,或者BoNT注射史没有明显的接触并不排除肉毒中毒的可能性。(推荐强度:强)
问题2:肉毒中毒的主要临床表现有哪些? 2.1 潜伏期主要与暴露的途径、毒素的剂量和吸收动力学有关,食源性肉毒中毒潜伏期多在12~72 h[16-17],注射性中毒潜伏期一般为6 d以内,外伤性中毒潜伏期多为4~14 d。潜伏期的长短也与BoNT的血清型有关,A型肉毒中毒的潜伏期波动于0~7 d,B型为0~5 d,E型为0~2 d。潜伏期越短,病情越重。
2.2 常见中毒症状及体征 2.2.1 特征性肌无力根据美国CDC的监测数据发现[18],98%有至少1种颅神经功能障碍相关症状,93%有下行性瘫痪,91%意识清醒,85%吞咽困难,81%上睑下垂,80%视力模糊,口齿不清,76%说话困难,67%声音沙哑和复视,65%呼吸短促。上述神经功能障碍主要为双侧对称性,但也有极少数案例报道神经症状出现非对称性改变[16],如F型中毒伴颅神经脱髓鞘[19]、局部单侧头颅外伤感染等[20]。
中毒症状和体征出现有一定的时间顺序,与中毒途径无关。中毒症状多为颅神经损害开始的“下行性”迟缓性瘫痪,发展顺序为:眼睑下垂、视物模糊、复视、畏光→构音障碍、发音困难、吞咽困难→抬头无力→上肢无力→呼吸肌无力→下肢无力,肢体肌无力多从肢体近端向远端发展。
2.2.2 自主神经症状主要表现为口干、胃肠道功能障碍、尿潴留、瞳孔固定或散大、体位性低血压、窦性心动过缓及低体温等。B型或E型肉毒中毒自主神经功能障碍更为常见。
2.2.3 其他症状食源性肉毒中毒发病前可有腹痛、腹泻、恶心和呕吐等消化道症状,且比其他类型的肉毒中毒患者更常见。
2.2.4 具有鉴别意义的症状一般无感觉障碍与认知功能障碍;早期无发热。
2.3 婴儿症候群其特征是胃肠道不适和抗胆碱能症状[17-18],便秘可以是首发症状,出现嗜睡、自发活动减少和食欲下降、吸吮无力,随后从轻度肌张力低下到对称性颅神经麻痹(上睑下垂,瞳孔反应迟钝和双面肌无力)、肌肉松弛性瘫痪,最终进展为累及膈肌。一般肌肉伸展反射通常不受影响。
2.4 创伤性肉毒中毒临床特点临床特征与食源性肉毒中毒相似,但有3个不同之处:通常无前驱胃肠道症状;潜伏期更长(约10 d);近半数有发热和白细胞增多[10],同时需要鉴别伤口合并感染。
推荐意见2:肉毒中毒特征性表现为急性、对称性、下行性、迟缓性瘫痪,一般不伴有发热、感觉和认知障碍。(推荐强度:强)
推荐意见3:便秘、嗜睡、自发活动减少和食欲下降、吸吮无力是婴儿肉毒神经毒素中毒的首发症状,一旦患者出现上述临床表现,需要警惕肉毒中毒的可能。(推荐强度:弱)
问题3:怀疑肉毒中毒需要做哪些检查? 3.1 样本的收集、运输及病原菌、毒素的检测 3.1.1 样本的收集和运输标本送检要求①一旦怀疑肉毒中毒,应该在应用肉毒抗毒素(botulinum antitoxin,BAT)前收集临床标本,以确保检测的敏感度及准确性;②采集患者5~10 mL全血(血液);③收集患者粪便10~20 g,血清中的毒素即便被BAT中和,但粪便中仍然可能存在肉毒杆菌及毒素,所以BAT治疗后依然可以收集粪便标本[19];④所有临床样本应立即冷藏(2~8℃),并保证冷链运输,标本不能冷冻;⑤创伤性肉毒中毒患者,可收集伤口处脓液或可疑组织样本送厌氧菌培养,但是阳性率不高;⑥多种标本的联合检测,能提高检测阳性率。
3.1.2 病原菌检查肠源性和创伤感染可以考虑进行厌氧菌培养识别微生物,但可能需要2~3周,大多数临床试验室不区分产毒型与非产毒型梭菌。
3.1.3 BoNT检测方法包括① 小鼠生物检测法[21]是肉毒中毒诊断的“金标准”。但此方法耗时较长,整个检测过程需4~6 d;②国内目前开展的检测方法为镧系高敏荧光免疫层析法、高效液相色谱质谱法;③其他检测方法包括:酶联免疫吸附试验(enzyme-linked immuno sorbent assay, ELISA)、测流实验、肽链内切酶质谱法(endopep-MS assay)等[22]。
3.2 其他实验室检查早期若无合并症,血常规、血液生化、脑脊液结果正常。病情进展且出现呼吸困难时,血气分析会提示低氧血症和二氧化碳潴留。
3.3 影像学检查肉毒中毒患者头颅CT/MRI影像学检查结果一般无异常。
3.4 电生理检查电生理检查包括重复性神经刺激(repetitive nerve stimulation,RNS)、肌电图(electromyography,EMG)和神经传导研究(nerve conduction studies,NCS),但是在肉毒中毒的早期,电生理检查多为正常[23]。后期肉毒中毒的典型表现是复合运动神经动作电位振幅的增加,RNS频率为30~50 Hz,肌纤维性颤动减少,EMG显示肌单位电位持续时间缩短,在NCS上运动诱发幅度下降,其他方面表现正常[24]。因此电生理检查的意义主要在于鉴别其他神经肌肉疾病(例如重症肌无力或吉兰-巴雷综合征),在肉毒中毒患者多为阴性,极少数为阳性[25-26]。在需要紧急处置的中毒患者,电生理检查的可行性也不高。
推荐意见4:一旦怀疑肉毒中毒,第一时间收集血液或粪便、创面标本送检,进行病原菌、BoNT检测。(推荐强度:强)
问题4:肉毒中毒的诊断流程? 4.1 疑似诊断所有不明原因急性发作颅神经异常者均应考虑到肉毒中毒的可能,为此美国CDC已开发一种具有循证学依据的临床诊断早期预警工具[27](表 2),以帮助临床医生快速识别散发性和暴发性肉毒中毒。该工具包含3个临床症候群,作为疑诊肉毒中毒的参考依据。同时满足早期预警工具①②③,肉毒中毒诊断敏感度达86%~89%。尤其同时出现颅神经损害4D征:Ddiplopia(复视),Dysarthria(构音障碍), Dysphonia(发音困难)和Dysphagia(吞咽困难),将有助于临床诊断。符合早期预警工具,同时常规检查正常、无意识及感觉障碍者应高度怀疑肉毒中毒。如果患者意识状态发生改变,需要考虑其他原因(如呼吸衰竭、吸毒或者酗酒、既往疾病或并发感染);伤口肉毒中毒出现发热需考虑合并其他细菌感染可能。
| 项目 | 指标 |
| ① | 无发热(体温<38℃) |
| ② | 至少有以下症状之一的急性发作 |
| 视力模糊 复视 言语困难(包括口齿不清) 声音改变(包括声音嘶哑) 吞咽困难、分泌物积聚或流涎 舌头肥厚 |
|
| ③ | 至少出现以下体征之一 |
| 上睑下垂 眼球运动障碍或疲劳 面神经受损(表现为面部表情消失或分泌物积聚,在幼儿中表现为进食困难、吸吮乳头或奶嘴困难或进食时疲劳) 瞳孔对光反射消失 从颅神经开始的下行性麻痹 |
肉毒中毒可疑患者如伴有以下高危因素:如食用罐头类食品、经皮肤注射毒品(尤其是特定型的海洛因)、12个月龄以下婴儿摄入蜂蜜、近期注射BoNT等即可临床诊断,并应将病例进行公共卫生事件上报,并送标本进行肉毒毒素或病原菌检测。需要注意的是没有上述高危因素也不能完全排除该病。
4.3 确定诊断有症状的患者检测到以下情况之一则可确诊为肉毒中毒:①血清、粪便或胃液中检测到BoNT;②粪便、伤口微生物培养出产BoNT的菌种(如肉毒梭菌、巴氏梭菌、丁酸梭菌);③患者所吃食物中检测到BoNT[28]。需要注意有症状者肉毒毒素检测或培养阴性并不能排除肉毒中毒,伤口肉毒中毒患者的毒素血清检测常为阴性,在73例注射吸毒相关伤口肉毒中毒患者中仅50例(68%)的血清中检出肉毒毒素[29]。此外伤口样本的厌氧菌培养可能并非阳性,尤其是已使用抗生素时[30]。
4.4 肉毒中毒病情分为4级[31-33]:轻度为眼部症状伴轻度头晕乏力,中度为轻度症状合并吞咽困难;重度为中度症状合并呼吸困难;骨骼肌和呼吸肌完全受累者称之为极重度。中度以上患者需鼻饲营养,重度患者要呼吸机支持。
推荐意见5:凡患者有至少一种颅神经特异度症状和体征且不伴发热可疑似诊断肉毒中毒;疑似诊断患者如有明确高危因素可临床诊断肉毒中毒;BoNT或者病原学检测阳性即可确定诊断。(推荐强度:中等)
推荐意见6:依据病情严重程度,肉毒中毒分为轻度、中度、重度和极重度,中度以上患者需要动态进行血气分析监测呼吸功能。(推荐强度:中等)
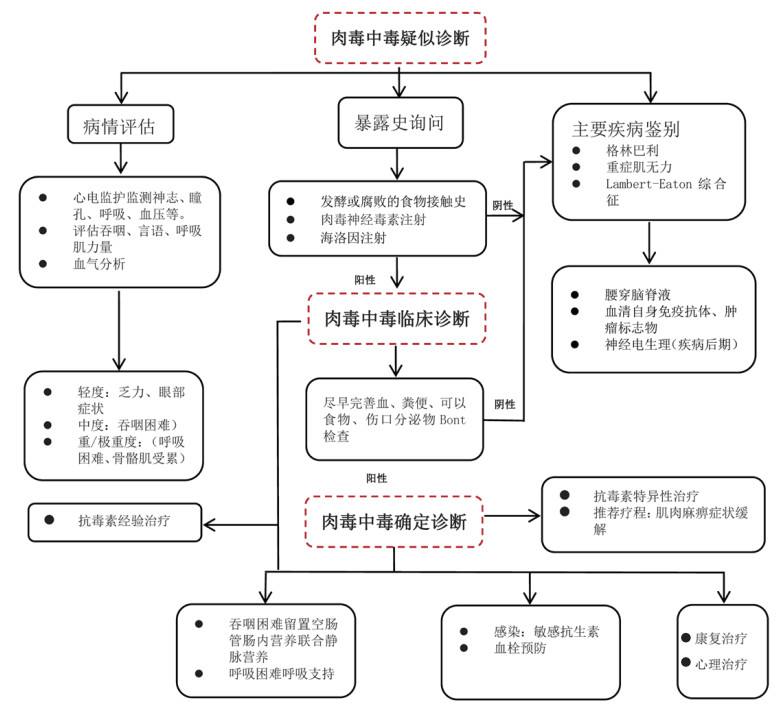
肉毒中毒诊治流程见图 2。
|
| 图 2 肉毒中毒诊治流程 |
|
|
肉毒中毒患者的进展性瘫痪虽具有一定特异度,但需与Lambert-Eaton综合征(兰伯特-伊顿综合征)、吉兰-巴雷综合征或重症肌无力等疾病相鉴别,鉴别要点见,表 3。
| 分类 | 肉毒中毒 | 重症肌无力 | 吉兰-巴雷综合征 | 兰伯特-伊顿综合征 |
| 前驱病史 | 肉毒暴露 | 无 | 感染 | 多合并肿瘤,尤其肺部肿瘤 |
| 瘫痪方式 | 有序的下行性 | 非有序的下行性 | 上行性,极少以颅神经受累起病 | 以肢体为主,颅神经一般不受累 |
| 眼肌受累 | 瞳孔扩大、麻痹 | 无 | 无 | 无 |
| 感觉障碍 | 无 | 无 | 多见 | 无 |
| 植物神经功能障碍 | 可有 | 无 | 可有,但不会影响瞳孔对光反射 | 可有,以口干及性功能障碍为主 |
| 脑脊液常规 | 无异常 | 无异常 | 蛋白细胞分离现象,早期可正常 | 无异常 |
| 神经电生理 | 突触前膜损害 | 突触后膜损害 | 周围神经损害 | 与肉毒中毒类似,但RNS高频刺激后MAP波幅递增明显 |
| 血液检查 | 无 | 相关自身免疫抗体阳性 | 可无异常 | 相关肿瘤标记物阳性 |
推荐意见7:肉毒中毒需要与其他神经肌肉疾病(Lambert-Eaton综合征、吉兰-巴雷综合征、重症肌无力等)相鉴别,鉴别要点包括流行病史、起病方式、临床症状以及脑脊液、神经电生理及血液学检查等。(推荐强度:中等)
问题6:肉毒中毒主要治疗措施包括哪些?肉毒中毒治疗的主要措施为对症支持治疗和抗毒素治疗。任何有疑治疗,并监测是否有进行性肌无力和需要气管插管的呼吸衰竭征象。
6.1 呼吸支持治疗重度以上肉毒中毒常有呼吸困难症状,近半数患者需要气管插管和机械通气。严重肉毒中毒可出现呼吸肌麻痹导致呼吸衰竭,是肉毒中毒患者急性期死亡的主要原因,因此监测呼吸功能和适时予以气管插管(用于气道保护和机械通气),是成功救治肉毒中毒并降低病死率的基石[34]。呼吸功能监测指标和气管插管指征参照吉兰-巴雷综合征,包括说话或休息时呼吸急促、使用辅助呼吸肌,以及下列指标:呼吸频率持续 > 30次/min、血氧饱和度 < 92%、急性高碳酸血症(PaCO2 > 50 mmHg, 1 mmHg=0.133 kPa),提示患者可能需机械通气[35]。临床医生还应意识到,肉毒中毒导致的面瘫可能掩盖临床呼吸窘迫表现,可能将出现呼吸衰竭的患者直到晚期才被发现[36]。
推荐意见8:肉毒中毒有以下症状:包括说话或休息时呼吸急促、呼吸频率持续 > 30次/min、使用辅助呼吸肌、血氧饱和度 < 92%、急性高碳酸血症(PaCO2 > 50 mmHg)等呼吸功能障碍时,建议及时行呼吸支持治疗。(推荐强度:中等)
6.2 抗毒素治疗疑似肉毒中毒需进行公共卫生事件上报,临床诊断肉毒中毒需尽快启动抗毒素BAT治疗。
BAT是一种来自马血清的抗体制剂,是BoNT中毒最有效的治疗方法。每种BAT只能特异度中和血清型对应的BoNT,抗毒素仅中和循环中的毒素,对于已经摄入神经末梢的毒素没有作用,因此抗毒素不能逆转患者的瘫痪症状,但可阻止瘫痪进展。有研究表明,使用抗毒素可减少机械通气天数、ICU住院天数和总住院天数[37]。
6.2.1 血清类型全球有多种肉毒中毒治疗制剂。美国有2种市售制剂:马血清七价BAT用于治疗非婴儿肉毒中毒;人源性肉毒杆菌免疫球蛋白用于治疗婴儿肉毒中毒[38-40]。目前国内主要用于临床的抗毒素血清有单价A、B型(可通过省市卫健委应急办联系申购),可根据当地流行病学资料进行经验性治疗,选择BAT的种类和数量,在得到毒素鉴定结果后再予以针对特定血清型的抗毒素。
6.2.2 血清使用时机由于目前确诊检测需要数天时间,临床推定诊断(实际为疑似诊断和临床诊断)为肉毒中毒,则应尽快给予抗毒素,不能因等待诊断性检查结果而延误治疗。
2016年Carrillo在文献报道提示,食源性肉毒中毒患者,24 h内使用BAT治疗的病死率为10%,24 h后使用或未使用BAT治疗的病死率分别为15%和46%,且24 h之内接受BAT治疗可缩短机械通气时间和住院时间[41]。因此,对高度疑似肉毒中毒的患者,无需等待检测结果,在接触BoNT后24 h内或在瘫痪发生前就使用BAT治疗[42]。
推荐意见9:患者疑似诊断或临床诊断为肉毒中毒,应尽快给予BAT治疗。(推荐强度:强)
推荐意见10:临床高度怀疑肉毒中毒且病情进展速度快,医生可根据当地流行病学资料经验性选择BAT,待诊断明确后给予针对特定血清型的抗毒素。(推荐强度:中等)
6.2.3 剂量及疗程至于BAT使用的剂量和频次,国内外尚无统一标准,国外主要为7价血清,国内目前只有单价血清,以A型抗毒素血清为例,对皮试阴性者,每次皮下、肌内或静脉注射1~2万U,1次/12 h;待病情好转后,酌情减量(如减半)或延长给药间隔时间。有研究表明,20%的肉毒中毒患者在症状发作后超过6 d,血液中仍可检测到残留BoNT[43-44]。也有报道显示,有症状进展的中毒患者在中毒后7~21 d开始抗毒素治疗,仍能有效改善症状[45-46]。因此关于抗毒素使用时间窗有一些建议或共识可借鉴[38]。只要患者瘫痪持续加重,就表明循环中有BoNT存在,无论发病时间多久,使用BAT治疗都可能获益。只有病情逐步稳定,致命的肌肉麻痹解除:如自主呼吸功能正常,吞咽困难消失,才可终止BAT治疗。
6.2.4 BAT的过敏反应及不良反应BAT作为外源蛋白的浓缩制剂,可引起人体的免疫反应,主要为过敏反应及血清病,数据显示BAT过敏反应率 < 2%[47]。也有资料表明过敏反应和血清病等不良反应的发生率分别为12%和1%~4%。在使用BAT之前,严格按照说明书进行皮试并观察可能过敏反应结果。可以提前给予糖皮质激素,并准备肾上腺素和抗组胺药物,确保能及时应对患者严重的过敏反应。
推荐意见11:鉴于目前BAT使用的剂量及疗程国内外尚无统一标准,建议结合临床经验并参照抗毒素血清说明书,推荐使用疗程为致命的肌肉麻痹症状解除为止。(推荐强度:中等)
6.3 营养支持肉毒中毒应常规评估患者的吞咽功能,如患者合并吞咽困难,应予以鼻饲治疗。肉毒中毒患者食管、胃幽门等部位的蠕动可能丧失,因此最好留置鼻空肠予以幽门后肠内营养支持治疗。肠内营养治疗期间,可给予胃肠动力药物,并密切监测胃肠道功能,必要时联合静脉营养确保患者能量需求。若患者出现麻痹性肠梗阻,需予以全胃肠外营养支持。
推荐意见12:肉毒中毒患者应常规评估吞咽功能,合并吞咽困难患者予以鼻饲饮食,优先考虑留置鼻空肠管予以幽门后营养支持,治疗期间严密监测胃肠道功能,必要时联合静脉营养确保患者能量需求。(推荐强度:中等)
6.4 伤口处理创伤性肉毒中毒患者应进行清创,以减少细菌负荷。如果没有伤口感染的证据(如无白细胞增多、发热、脓肿或蜂窝织炎)不常规给予抗菌治疗[48]。若患者确实有提示伤口感染的特征则适合给予抗生素治疗。如果这些患者上一次接种破伤风疫苗≥5年,还应接种加强针。
推荐意见13:创伤性肉毒中毒患者应第一时间清创处理,以减少细菌负荷。(推荐强度:强)
6.5 并发症的防治长期重症监护的患者容易出现并发症,如呼吸机相关性肺炎和深静脉血栓(deep venous thrombosis,DVT)形成,应注意加强管理进行预防,以上并发症是肉毒中毒患者晚期死亡的主要原因[48]。
6.5.1 抗菌治疗肉毒中毒患者不常规推荐使用抗生素,但肉毒中毒患者后期容易并发肺部感染、尿路感染等并发症,合并感染的患者,应进行病原学检查,选择敏感抗生素治疗,但需注意避免使用氨基糖苷类、四环素、多黏菌素等可能出现神经肌肉阻滞的抗生素[49]。
6.5.2 血栓预防肉毒中毒患者长期卧床容易发生DVT,入院后第一时间行下肢深静脉血栓筛查并给予血栓预防措施,比如气压治疗与低分子肝素抗凝等。
推荐意见14:肉毒中毒不推荐常规预防性抗菌治疗,一旦确定并发感染,建议选择敏感抗生素治疗,但应该避免使用影响神经肌肉传导的抗生素。(推荐强度:中等)
推荐意见15:肉毒中毒卧床患者应动态进行VTE评分,根据评分结果规范启动血栓预防治疗。(推荐强度:中等)
声明: 本专家共识是基于当前的临床证据、循证医学证据以及专家意见,仅为急诊临床诊疗肉毒中毒提供指导,不作为任何医疗纠纷及诉讼的法律依据。
利益冲突 所有作者声明无利益冲突
执笔人:周利平(中南大学湘雅医院)、秦杰(浙江省台州医院)、江涛(湖南医药学院总医院)、李金(南昌大学第二附属医院)
制定共识组专家组成员(按姓氏拼音顺序排列):李湘民(中南大学湘雅医院国家老年疾病临床医学研究中心(湘雅医院)),李金(南昌大学第二附属医院),崇巍(中国医科大学附属第一医院),陈旭锋(南京医科大学第一附属医院),陈凤英(内蒙古医科大学附属医院),曹钰(四川大学华西医院),邓颖(哈尔滨医科大学附属第二医院),高艳霞(郑州大学第一附属医院),何小军(中华急诊医学杂志),蒋龙元(中山大学孙逸仙纪念医院),卢中秋(温州医科大学附属第一医院),李欣(广东省人民医院),李培武(兰州大学第二医院),李燕(山西医科大学第二医院),李文华(娄底市中心医院),胡加伶(南昌大学第二附属医院),胡莹莹(河南科技大学第一附属医院),江涛(湖南医药学院总医院),刘明华(陆军军医大学第一附属医院(西南医院)),毛恩强(上海交通大学医学院附属瑞金医院),闵军(福建省福州市第二总医院),聂时南(解放军东部战区总医院),牛旭平(吐鲁番市人民医院)欧阳艳红(海南省人民医院),彭鹏(新疆医科大学第一附属医院), 秦杰(浙江省台州医院), 孙传政(中南大学湘雅三医院),孙同文(郑州大学第一附属医院),吴利东(南昌大学第二附属医院),吴海鹰(昆明医科大学第一附属医院), 王振杰(蚌埠医科大学第一附属医院), 王瑞兰(上海第一人民医院), 王威(广西医科大学第一附属医院),徐军(北京协和医院),徐善祥(浙江大学医学院附属第二医院),于学忠(北京协和医院),杨立山(宁夏医科大学总医院),赵刚(华中科技大学同济医学院附属协和医院), 郑粉双(云南大学附属医院),赵晓东(中国人民解放军总医院第四医学中心),朱华栋(北京协和医院),周利平(中南大学湘雅医院国家老年疾病临床医学研究中心(湘雅医院)
| [1] | Rao AK, Lin NH, Jackson KA, et al. Clinical characteristics and ancillary test results among patients with botulism-United States, 2002-2015[J]. Clin Infect Dis, 2017, 66(suppl_1): S4-S10. DOI:10.1093/cid/cix935 |
| [2] | Sobel J. Botulism[J]. Clin Infect Dis, 2005, 41(8): 1167-1173. DOI:10.1086/444507 |
| [3] | Filozov A, Kattan JA, Jitendranath L, et al. Asymmetric type F botulism with cranial nerve demyelination[J]. Emerg Infect Dis, 2012, 18(1): 102-104. DOI:10.3201/eid1801.110471 |
| [4] | Cherington M. Clinical spectrum of botulism[J]. Muscle Nerve, 1998, 21(6): 701-710. DOI:10.1002/(sici)1097-4598(199806)21:6<701::aid-mus1>3.0.co;2-b |
| [5] | Freeman MD, Margulies IG, Sanati-Mehrizy P, et al. Nonaesthetic applications for botulinum toxin in plastic surgery[J]. Plast Reconstr Surg, 2020, 146(1): 157-170. DOI:10.1097/PRS.0000000000006908 |
| [6] | Rao AK, Sobel J, Chatham-Stephens K, et al. Clinical guidelines for diagnosis and treatment of botulism, 2021[J]. MMWR Recomm Rep, 2021, 70(2): 1-30. DOI:10.15585/mmwr.rr7002a1 |
| [7] | Goerttler T, Dorner MB, van der Linden C, et al. Iatrogenic botulism after intragastric botulinum neurotoxin injections–a major outbreak[J]. Neurol Res Pract, 2024, 6(1): 52. DOI:10.1186/s42466-024-00350-3 |
| [8] | Ahsanuddin S, Roy S, Nasser W, et al. Adverse events associated with Botox as reported in a food and drug administration database[J]. Aesthetic Plast Surg, 2021, 45(3): 1201-1209. DOI:10.1007/s00266-020-02027-z |
| [9] | Mechem CC, Walter FG. Wound botulism[J]. Vet Hum Toxicol, 1994, 36(3): 233-237. |
| [10] | Edwards LD, Gomez I, Wada S, et al. Notes from the field: wound botulism outbreak among a group of persons who inject drugs - Dallas, Texas, 2020[J]. MMWR Morb Mortal Wkly Rep, 2022, 71(15): 556-557. DOI:10.15585/mmwr.mm7115a3 |
| [11] | Middaugh N, Edwards L, Chatham-Stephens K, et al. Wound botulism among persons who inject black tar heroin in new Mexico, 2016[J]. Front Public Health, 2021, 9: 744179. DOI:10.3389/fpubh.2021.744179 |
| [12] | Malov VA, Maleev VV, Chulanov VP, et al. Infant botulism: an underestimated problem. A review[J]. Ter Arkh, 2024, 96(11): 1069-1075. DOI:10.26442/00403660.2024.11.202999 |
| [13] | Goldberg B, Danino D, Levinsky Y, et al. Infant botulism, Israel, 2007–2021[J]. Emerg Infect Dis, 2023, 29(2): 235-241. DOI:10.3201/eid2902.220991 |
| [14] | Guru PK, Becker TL, Stephens A, et al. Adult intestinal botulism: a rare presentation in an immunocompromised patient with short bowel syndrome[J]. Mayo Clin Proc Innov Qual Outcomes, 2018, 2(3): 291-296. DOI:10.1016/j.mayocpiqo.2018.06.005 |
| [15] | Shapiro RL, Hatheway C, Swerdlow DL. Botulism in the United States: a clinical and epidemiologic review[J]. Ann Intern Med, 1998, 129(3): 221-228. DOI:10.7326/0003-4819-129-3-199808010-00011 |
| [16] | Gerald L. Mandell E B, Raphael D. Douglas and Bennett's principles and practice of infectious diseases. 5th [J]. Churchill Livingstone, 2000. |
| [17] | Jeffery IA, Karim S. Botulism. 2023 Jul 17. In: StatPearls [Internet]. Doi: 10.47165/9781955022002. |
| [18] | Rao AK, Lin NH, Griese SE, et al. Clinical criteria to trigger suspicion for botulism: an evidence-based tool to facilitate timely recognition of suspected cases during sporadic events and outbreaks[J]. Clin Infect Dis, 2017, 66(suppl_1): S38-S42. DOI:10.1093/cid/cix814 |
| [19] | Filozov A, Kattan JA, Jitendranath L, et al. Asymmetric type F botulism with cranial nerve demyelination[J]. Emerg Infect Dis, 2012, 18(1): 102-104. DOI:10.3201/eid1801.110471 |
| [20] | Jacobs Slifka K, Harris JA, Nguyen V, et al. A case of localized, unilateral (cephalic) wound botulism[J]. Clin Infect Dis, 2017, 66(suppl_1): S95-S98. DOI:10.1093/cid/cix828 |
| [21] | Perry MJ, Centurioni DA, Davis SW, et al. Implementing the bruker MALDI biotyper in the public health laboratory for C. botulinum neurotoxin detection[J]. Toxins (Basel), 2017, 9(3): 94. DOI:10.3390/toxins9030094 |
| [22] | 王江, 徐华, 谢剑炜. 肉毒毒素检测方法研究进展[J]. 生物技术通信, 2018, 29(4): 576-581. DOI:10.3969/j.issn.1009-0002.2018.04.024 |
| [23] | Mallik A, Weir AI. Nerve conduction studies: essentials and pitfalls in practice[J]. J Neurol Neurosurg Psychiatry, 2005, 76(Suppl 2): ii23-ii31. DOI:10.1136/jnnp.2005.069138 |
| [24] | Reid Harvey R, Cooper R, Bennett S, et al. Outbreak of foodborne botulism in an immigrant community: overcoming delayed disease recognition, ambiguous epidemiologic links, and cultural barriers to identify the cause[J]. Clin Infect Dis, 2017, 66(suppl_1): S82-S84. DOI:10.1093/cid/cix817 |
| [25] | Maslanka SE, Solomon HM, Sharma S, et al. 32. Clostridium botulinumand its toxins[M]//Compendium of Methods for the Microbiological Examination of Foods. American Public Health Association, 2013 DOI: 10.2105/mbef.0222.037. |
| [26] | Maselli RA, Ellis W, Mandler RN, et al. Cluster of wound botulism in California: clinical, electrophysiologic, and pathologic study[J]. Muscle Nerve, 1997, 20(10): 1284-1295. DOI:10.1002/(sici)1097-4598(199710)20:10<1284::aid-mus11>3.0.co;2-3 |
| [27] | Padua L, Aprile I, Monaco ML, et al. Neurophysiological assessment in the diagnosis of botulism: usefulness of single-fiber EMG[J]. Muscle Nerve, 1999, 22(10): 1388-1392. DOI:10.1002/(sici)1097-4598(199910)22:10<1388::aid-mus8>3.0.co;2-3 |
| [28] | Mallik A, Weir AI. Nerve conduction studies: essentials and pitfalls in practice[J]. J Neurol Neurosurg Psychiatry, 2005, 76(Suppl 2): ii23-ii31. DOI:10.1136/jnnp.2005.069138 |
| [29] | Wheeler C, Inami G, Mohle-Boetani J, et al. Sensitivity of mouse bioassay in clinical wound botulism[J]. Clin Infect Dis, 2009, 48(12): 1669-1673. DOI:10.1086/599029 |
| [30] | 孙宝迪, 季青峰, 俞燕露, 等. 2021年美国CDC肉毒杆菌中毒临床诊疗指南解读[J]. 中国急救复苏与灾害医学杂志, 2022, 17(2): 145-149. DOI:10.3969/j.issn.1673-574x.2022.02.008 |
| [31] | Rao AK, Lin NH, Griese SE, et al. Clinical criteria to trigger suspicion for botulism: an evidence-based tool to facilitate timely recognition of suspected cases during sporadic events and outbreaks[J]. Clin Infect Dis, 2017, 66(suppl_1): S38-S42. DOI:10.1093/cid/cix814 |
| [32] | 高萌, 白丽丽, 林国东, 等. 380例注射肉毒毒素美容中毒患者的临床分析[J]. 中华急诊医学杂志, 2020, 29(6): 820-825. DOI:10.3760/cma.j.issn.1671-0282.2020.06.016 |
| [33] | Wheeler C, Inami G, Mohle-Boetani J, et al. Sensitivity of mouse bioassay in clinical wound botulism[J]. Clin Infect Dis, 2009, 48(12): 1669-1673. DOI:10.1086/599029 |
| [34] | 张鹏, 董建光, 白丽丽, 等. 53例肉毒杆菌食物中毒临床病例分析[J]. 中华危重病急救医学, 2017, 29(5): 459-464. DOI:10.3760/cma.j.issn.2095-4352.2017.05.014 |
| [35] | 田英平, 石汉文, 佟飞, 等. 肉毒中毒诊疗方案[J]. 中华急诊医学杂志, 2010, 19(4): 349-350. DOI:10.3760/cma.j.issn.1671-0282.2010.04.004 |
| [36] | O'Horo JC, Harper EP, El Rafei A, et al. Efficacy of antitoxin therapy in treating patients with foodborne botulism: a systematic review and Meta-analysis of cases, 1923-2016[J]. Clin Infect Dis, 2017, 66(suppl_1): S43-S56. DOI:10.1093/cid/cix815 |
| [37] | Narayanan N, Lacy CR, Cruz JE, et al. Disaster preparedness: biological threats and treatment options[J]. Pharmacotherapy, 2018, 38(2): 217-234. DOI:10.1002/phar.2068 |
| [38] | Sobel J. Diagnosis and treatment of botulism: a century later, clinical suspicion remains the cornerstone[J]. Clin Infect Dis, 2009, 48(12): 1674-1675. DOI:10.1086/599030 |
| [39] | BAT, Botulism antitoxin heptavalent (A, B, C, D, E, F, G) - (equine) sterile solution for injection. |
| [40] | Arnon SS, Schechter R, Maslanka SE, et al. Human botulism immune globulin for the treatment of infant botulism[J]. N Engl J Med, 2006, 354(5): 462-471. DOI:10.1056/NEJMoa051926 |
| [41] | Cabrera Serrano M, Rabinstein AA. Causes and outcomes of acute neuromuscular respiratory failure[J]. Arch Neurol, 2010, 67(9): 1089. DOI:10.1001/archneurol.2010.207 |
| [42] | Long SS. BabyBIG has BIG advantages for treatment of infant botulism[J]. J Pediatr, 2018, 193: 1. DOI:10.1016/j.jpeds.2017.12.002 |
| [43] | Yu PA, Lin NH, Mahon BE, et al. Safety and improved clinical outcomes in patients treated with new equine-derived heptavalent botulinum antitoxin[J]. Clin Infect Dis, 2017, 66(suppl_1): S57-S64. DOI:10.1093/cid/cix816 |
| [44] | Schussler E, Sobel J, Hsu J, et al. Workgroup report by the joint task force involving American academy of allergy, asthma & immunology (AAAAI); food allergy, anaphylaxis, dermatology and drug allergy (FADDA) (adverse reactions to foods committee and adverse reactions to drugs, biologicals, and latex committee); and the centers for disease control and prevention botulism clinical treatment guidelines workgroup-allergic reactions to botulinum antitoxin: a systematic review[J]. Clin Infect Dis, 2017, 66(suppl_1): S65-S72. DOI:10.1093/cid/cix827 |
| [45] | Carrillo-Marquez MA. Botulism[J]. Pediatr Rev, 2016, 37(5): 183-192. DOI:10.1542/pir.2015-0018 |
| [46] | Wendt S, Eder I, Wolfel R, et al. Botulismidiagnosis and therapy[J]. Dtsch Med Wochenschr, 2017, 142(17): 1304-1312. DOI:10.3238/arztebl.2017.01304 |
| [47] | Harms M. Inpatient management of guillain-Barré syndrome[J]. Neurohospitalist, 2011, 1(2): 78-84. DOI:10.1177/1941875210396379 |
| [48] | Hughes RA, Bihari D. Acute neuromuscular respiratory paralysis[J]. J Neurol Neurosurg Psychiatry, 1993, 56(4): 334-343. DOI:10.1136/jnnp.56.4.334 |
| [49] | 中华医学会整形外科学分会微创美容学组, 中华医学会医学美学与美容学分会微创美容学组, 等. 注射性肉毒中毒专家共识[J]. 中华医学美学美容杂志, 2019, 25(5): 351-353. DOI:10.3760/cma.j.issn.1671-0290.2019.05.001 |
 2025, Vol. 34
2025, Vol. 34