敌草快(diquat, DQ)是一种高效且环保的非选择性联吡啶类除草剂,广泛应用于农业生产活动中。同时,DQ也是临床中毒事件的常见元凶,毒性较强,致死率高达60%[1]。随着百草枯的禁售,DQ的使用频率迅速上升,因而DQ中毒人数也显著增加。与百草枯毒性有所不同,DQ毒性主要累及肾脏、肝脏以及胃肠等脏器,对肺部损伤较轻微[2]。DQ进入体内后首先损伤消化道,患者出现腹部剧烈疼痛以及麻痹性肠梗阻;随后在肾脏浓缩沉积,产生肾脏毒性,临床表现为肌酐急速升高,伴随血尿、蛋白尿、少尿或无尿,常规利尿剂无效,甚至部分重症患者在24 h内进展为急性肾衰竭,最终死于多脏器衰竭[3]。研究表明,DQ毒性可能与炎症反应、氧化应激等机制相关,但其具体机制未完全阐明,且临床救治方法没有明显突破,仍未发现特效解毒药物[4]。基于DQ复杂的多脏器毒性,笔者认为进一步深入地研究DQ损伤脏器的毒性机制,寻找潜在的分子靶点对提高临床救治率有重要的临床价值。
基于质谱的蛋白质组学技术通过解析生物体内组织以及细胞中的蛋白质整体表达、修饰状态以及蛋白质互作情况,为挖掘疾病发生的内在机制、诊断或预后生物标志物和潜在的治疗靶点提供新的思路和信息[5]。Chen等[6]应用基于液质联用(liquid chromatography-mass spectrometry, LC-MS)的蛋白组学技术研究了DQ对人肾上皮细胞胞内蛋白质表达的影响。Zhang等[7]联合蛋白质组、转录组等多组学技术在动物水平揭示了DQ中毒小鼠与健康小鼠的肾脏内在分子差异。目前,尚无文献报道急性DQ中毒患者体内的血浆蛋白质组研究。鉴于此,本研究通过基于纳升液相色谱串联四极杆飞行时间质谱(nano-liquid chromatography tandem quadrupole time-of flight mass spectrometry, nanoLC-QTOF-MS)的非靶向蛋白质组学技术,挖掘DQ中毒患者与健康人群之间的血浆蛋白表达的差异,从蛋白质角度揭示DQ毒性可能的内在分子机制,并为开发诊疗和预后相关的生物标志物提供新的思路。
1 资料与方法 1.1 研究对象本研究为病例对照研究。收集南京大学医学院附属鼓楼医院2022年8月至2023年12月收治的敌草快中毒患者的基本临床资料和血浆样本。纳入标准:(1)服用敌草快中毒后24 h内入院;(2)血浆敌草快浓度采用液相色谱法测定,大于定量下限0.4 µg/mL。排除标准:(1)合并严重心、脑血管疾病;(2)合并肝、肾、血液、自身免疫性疾病或恶性肿瘤;(3)合并其他毒物中毒;(4)临床资料不完整。选取同期7例匹配年龄与性别的健康人血浆样本作为对照组。本研究遵循《赫尔辛基宣言》中医学研究的伦理原则,经南京大学医学院附属鼓楼医院医学伦理委员会批准,批件号:2022-055-02。
1.2 样本制备 1.2.1 蛋白消化取10 µL血浆,应用蛋白提取小柱(Thermo scientific, 美国)去除血浆样本中的白蛋白和免疫球蛋白。所得蛋白溶液用BCA试剂盒(上海生工,中国)进行蛋白浓度检测。蛋白样品的消化采用过滤辅助样品制备(filter-aided sample preparation, FASP)方法[8]。蛋白溶液首先在56 ℃下,加入200 µL的10 mM二硫苏糖醇还原1 h;然后将蛋白混合溶液转移至30 kDa超滤装置离心20 min, 以去除多余反应物质以及其它低分子量成分;再在室温避光条件下,加入200 µL的25 mmol/L碘乙酰胺溶液孵育30 min,进一步烷基化蛋白质。下一步,离心蛋白质溶液,加入200 µL尿素溶液洗涤两次;最后,将10 µg胰蛋白酶(蛋白与胰酶比例为20∶1)加入过滤管中,血浆蛋白在37 ℃下消化12 h。14 000 g转速离心15 min收集酶解的蛋白多肽,-80 ℃下储存。
1.2.2 HPLC分级每个酶解样本各取20 µg多肽均匀混合后,通过反向高pH高效液相色谱法(high performance liquid chromatography, HPLC)对300 µg多肽混合物进行分级。多肽混合物由流动相A(2%乙腈,pH 10.0)稀释,并由C18柱(Waters,XBridge BEH C18柱,130 Å,4.6 mm×150 mm,5 µm)分离。在60 min内,通过逐渐增加流动相B(98%乙腈,pH 10.0)的浓度(5%~95%),对多肽进行梯度洗脱。最终,将60个馏分合并为12个馏分,真空浓缩干燥后-20 ℃保存。
1.3 样本分析色谱条件:Eksigent ekspertTM nanoLC 415纳升液相色谱(SCIEX,美国)。富集柱为ChromXP C18-CL(5 µm,120 Å,Eksigent,SCIEX);分析柱为ChromXP C18(3 μm, 120 Å,0.3×150 mm,Eksigent,SCIEX)。流动相:A相,0.1%甲酸水溶液(含2%乙腈);B相,0.1%甲酸的乙腈(含2%水)。流速为3 µL/min,进样体积:2 µL。流动相梯度:0~50 min,5%~35% B;50~51 min,35%~80% B;51~54 min,80% B;54~55 min,80%~5% B;55~60 min,5% B。
质谱条件:TripleTOF 5600高分辨质谱仪(SCIEX,美国)。在正离子模式进行质谱检测,MS质荷比扫描范围:350~1 250;MS/MS质荷比扫描范围:100~1 500;气帘气:30 psi;离子源气体1∶15 psi;离子源气体2∶20 psi;离子喷雾电压浮动:5 500 V;去簇电压:100 V。
1.4 数据处理质谱数据由Analyst TF 1.7.1软件(SCIEX,美国)获取,并由ProteinPilotTM软件5.0(SCIEX,美国)根据Uniprot数据库进行检索。ProteinPilot的搜索设置如下:半胱氨酸烷基化修饰:碘乙酰胺;酶解方式:胰蛋白酶;物种来源:人类。设定鉴定蛋白质的假阳性率(FDR)≤1%。蛋白质的鉴定依靠蛋白质所属特征多肽的鉴定,每个蛋白至少有一条特征多肽。蛋白质的相对定量基于对应特征多肽的含量。
1.5 生物信息学分析鉴定所得差异蛋白质的基因本体(gene ontology, GO)分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析应用DAVID(database for annotation, visualization and integrated discovery)数据库完成。其中GO分析包含差异蛋白质的生物过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)3个类别。
1.6 统计学方法采用SPSS 26.0版软件分析数据,正态分布的计量数据以均值±标准差(x±s)表示分布特征,并采用独立样本t检验比较两组差异。非正态分布的计量资料使用中位数(四分位数)[M(Q1, Q3)]表示,使用Mann Whitney U检验比较两组差异。P<0.05认为差异有统计学意义。
2 结果 2.1 患者基本情况本次研究纳入8例DQ急性中毒患者,健康志愿者7例。中毒组与健康对照组的年龄、性别差异无统计学意义。中毒患者年龄分布于16~65岁,以30岁以上人群为主。8例中毒患者,6例为男性患者,占75%,见表 1。此外,根据DQ中毒患者的结局分为存活与死亡两个亚组,两亚组的年龄、性别、入院时服药时长、服药剂量、血浆DQ浓度和急性生理与慢性健康评分(acute physiology and chronic health evaluation, APACHE)均差异无统计学意义。值得注意的是,死亡组的序贯器官衰竭估计评分(sequential organ failure assessment, SOFA)显著高于存活组,见表 2。
| 指标 | 健康对照(n=7) | 中毒组(n=8) | t/χ2值 | P值 |
| 年龄(岁)a | 41.1±6.6 | 39.1±16.4 | -0.206 | 0.766 |
| 性别(男/女) | 4/3 | 6/2 | 0.536 | 0.464 |
| 服药时长(h)b | - | 9 (7, 13) | ||
| 服用体积(mL)b | - | 50 (41, 125) | ||
| DQ浓度(mg/L)a | - | 1.8±1.6 | ||
| APACHE评分a | - | 8.5±6.4 | ||
| SOFA评分a | - | 5.2±4.4 | ||
| 注:DQ为敌草快;a为x±s,b为M(Q1, Q3) | ||||
| 指标 | 死亡组(n=4) | 存活组(n=4) | t/χ2值 | P值 |
| 年龄(岁)a | 44.8±8.5 | 33.5±21.7 | -0.852 | 0.371 |
| 性别(男/女) | 3/1 | 3/1 | 0.000 | 1.000 |
| 服药时长(h)b | 13 (8, 19) | 8 (6, 10) | 1.280 | 0.686 |
| 服用体积(mL)b | 150 (79, 213) | 50 (39, 50) | 1.246 | 0.200 |
| DQ浓度(mg/L)a | 1.9±1.1 | 1.8±2.2 | -0.111 | 0.926 |
| APACHE评分a | 12.2±4.3 | 4.8±6.2 | -3.814 | 0.094 |
| SOFA评分a | 8.5±3.1 | 2.0±2.8 | 23.156 | 0.021 |
| 注:DQ为敌草快;a为x±s,b为M(Q1, Q3) | ||||
本次样本蛋白建库的总离子流图(total ion chromatogram, TIC)如图 1所示,蓝色为一级质谱图(MS1),红色为二级质谱图(MS2)。中毒患者与健康志愿者的血浆蛋白检测的TIC图,整体峰形趋于一致,如图 2示。
|
| 图 1 蛋白建库的总离子流图 Fig 1 TIC of construction of protein library |
|
|
|
| 图 2 DQ中毒患者(A)和健康人(B)的血浆蛋白的TIC图 Fig 2 TIC of plasma proteins in DQ poisoned patients (A) and healthy controls (B) |
|
|
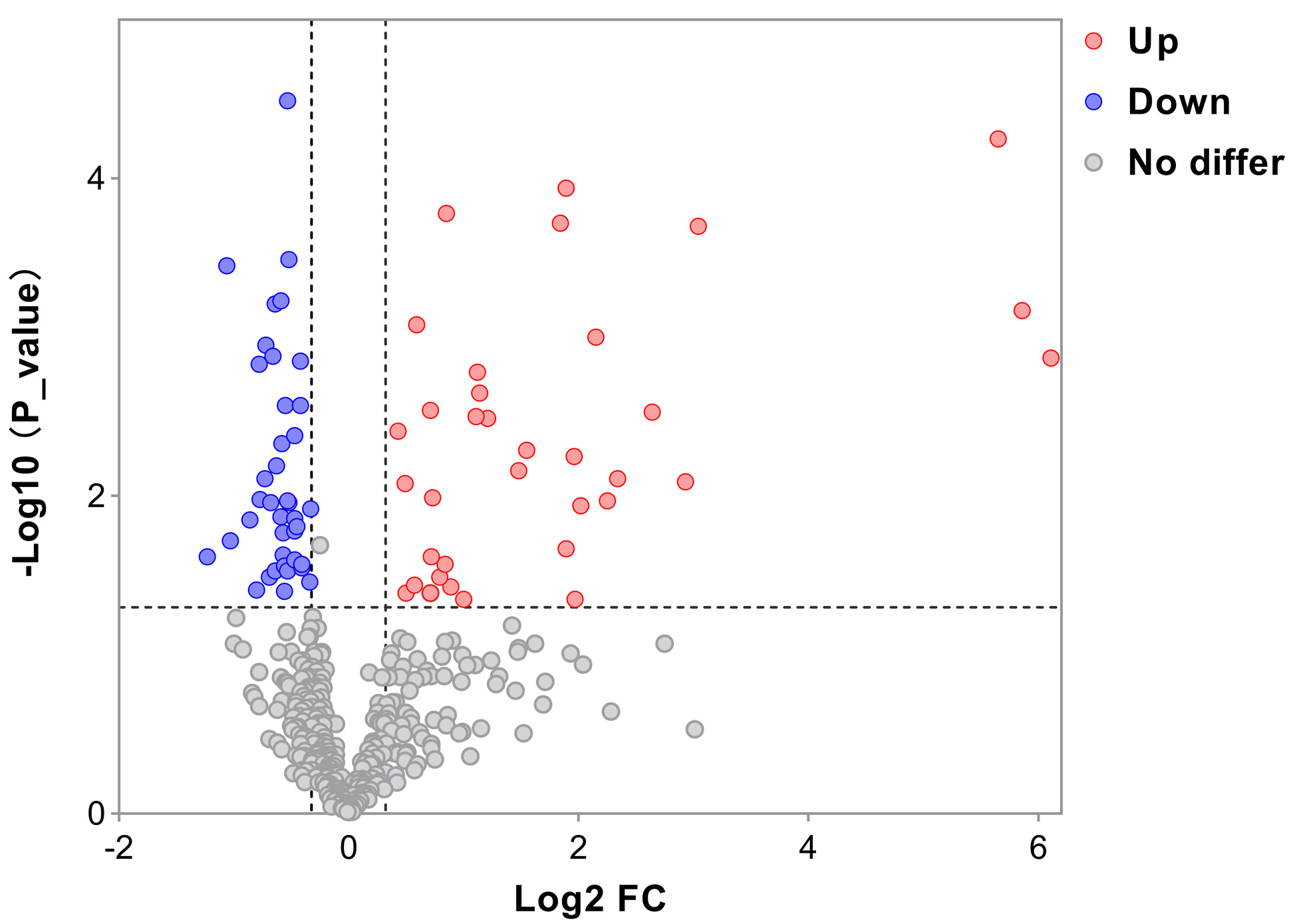
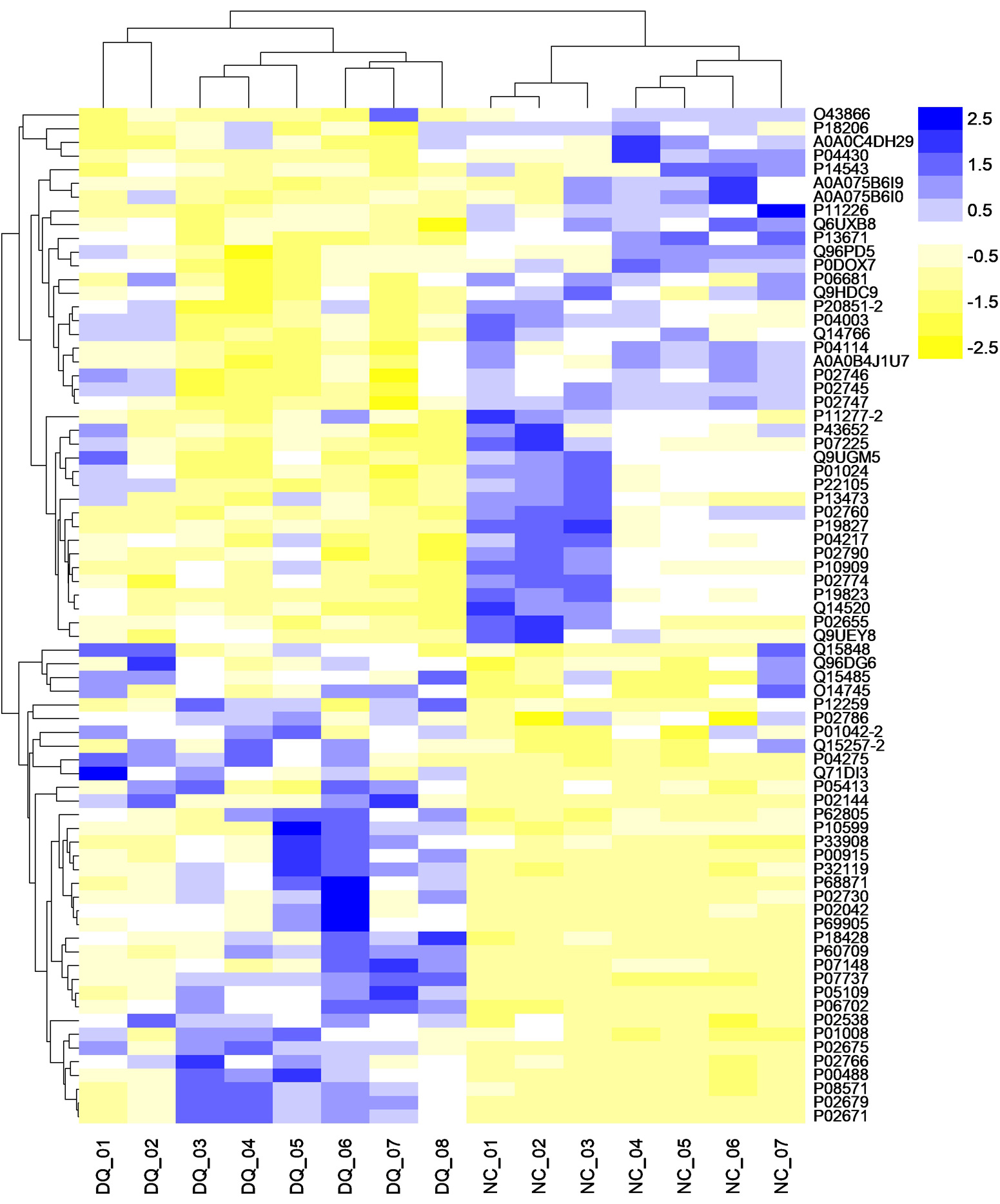
经鉴定,本次样本蛋白库共有491个血浆蛋白。差异表达蛋白的筛选标准为峰面积倍数变化(fold change, FC)>1.25或<0.8,且P<0.05。与对照组相比,DQ急性中毒组有76个差异表达蛋白,包含35个上调蛋白和41个下调蛋白,火山图见图 3。差异表达蛋白在每个样本中表达的层次聚类热图见图 4,可见差异表达蛋白在两组中水平差异显著,能明显区分两组人群。差异倍数排名前10的血浆蛋白的具体信息见表 3。此外,根据随访的患者结局,将DQ急性中毒患者分为2个亚组,存活组(n=4)和死亡组(n=4)。死亡组与存活组相比,共有19个差异蛋白,包含14个上调蛋白,5个下调蛋白(表 4)。经对比,发现脂联蛋白(adiponectin, ADIPOQ)不仅在DQ中毒患者体内表达增加,在中毒后死亡患者中的表达升高尤其显著。
|
| 图 3 差异表达蛋白的火山图 Fig 3 Volcano plot of the differentially expressed proteins |
|
|
|
| 图 4 差异表达蛋白的聚类热图 Fig 4 Hierarchial clustering heatmap of the differentially expressed proteins |
|
|
| 编号 | 基因 | 蛋白 | 差异倍数 | P值 |
| 上调蛋白 | ||||
| P02671 | FGA | 纤维蛋白原α链 | 69.23 | 0.0013 |
| P02679 | FGG | 纤维蛋白原γ链 | 58.11 | 0.0007 |
| P02675 | FGB | 纤维蛋白原β链 | 50.31 | 0.0001 |
| P02144 | MB | 肌红蛋白 | 7.62 | 0.0080 |
| P06702 | S100A9 | 蛋白质S100-A9 | 8.23 | 0.0002 |
| P05109 | S100A8 | 蛋白质S100-A8 | 6.24 | 0.0029 |
| P69905 | HBA1 | 血红蛋白亚单位α | 5.06 | 0.0078 |
| P02730 | SLC4A1 | 带3阴离子转运蛋白 | 4.76 | 0.0107 |
| P60709 | ACTB | 肌动蛋白 | 4.45 | 0.0010 |
| P02042 | HBD | 血红蛋白亚单位δ | 4.06 | 0.0114 |
| 下调蛋白 | ||||
| Q9UEY8 | ADD3 | Rab11家族相互作用蛋白3 | 0.43 | 0.0239 |
| P04430 | IGKV1-16 | 免疫球蛋白κ变体1-16 | 0.49 | 0.0191 |
| P02747 | C1QC | 补体C1q亚组分B亚基 | 0.48 | 0.0004 |
| P18206 | VCL | 黏着斑蛋白 | 0.55 | 0.0142 |
| A0A0C4DH29 | IGHV1-3 | 免疫球蛋白重变量1-3 | 0.57 | 0.0386 |
| A0A075B6I0 | IGLV8-61 | 免疫球蛋白λ变量8-61 | 0.59 | 0.0104 |
| Q14766 | LTBP1 | 潜在转化生长因子β结合蛋白1 | 0.60 | 0.0078 |
| O43866 | CD5L | CD5抗原样蛋白 | 0.62 | 0.0325 |
| Q14520 | HABP2 | 透明质酸结合蛋白2 | 0.58 | 0.0015 |
| P11277-2 | SPTB | 血影蛋白β链 | 0.64 | 0.0294 |
| 编号 | 基因 | 蛋白 | 差异倍数 | P值 |
| 上调蛋白 | ||||
| P00748 | F12 | 凝血因子XII | 1.81 | 0.0068 |
| P04180 | LCAT | 磷脂酰胆碱甾醇酰基转移酶 | 1.73 | 0.0235 |
| Q15848 | ADIPOQ | 脂联蛋白 | 1.70 | 0.0089 |
| P04003 | C4BPA | C4b结合蛋白α链 | 1.60 | 0.0343 |
| P20851-2 | C4BPB | C4b结合蛋白β链 | 1.58 | 0.0171 |
| P09871 | C1S | 补体C1s子成分 | 1.48 | 0.0223 |
| P01024 | C3 | 补体C3 | 1.48 | 0.0280 |
| Q08830 | FGL1 | 纤维蛋白原样蛋白1 | 1.46 | 0.0452 |
| P49747 | COMP | 软骨寡聚基质蛋白 | 1.43 | 0.0438 |
| P07225 | PROS1 | 维生素K依赖性蛋白S | 1.39 | 0.0262 |
| 下调蛋白 | ||||
| P00738 | HP | 触珠蛋白 | 0.28 | 0.0035 |
| P31146 | CORO1A | 冠蛋白1A | 0.43 | 0.0435 |
| P17174 | GOT1 | 天冬氨酸转氨酶 | 0.49 | 0.0304 |
| P12259 | F5 | 凝血因子V | 0.65 | 0.0361 |
| P67936 | TPM4 | 原肌球蛋白α-4链 | 0.74 | 0.0491 |
筛选所得35个上调蛋白和41个下调蛋白分别进行GO和KEGG分析,图 5和图 6展示富集在前十名的子类。GO注释结果显示差异蛋白主要富集在细胞外泌体、血液微粒、细胞外区域、细胞外空间等细胞组分类;血液凝固、氧气输送、过氧化氢分解过程、补体激活、固有免疫应答等生物过程类;以及氧转运蛋白活性、受体结合、氧结合、透明质酸结合、内肽酶抑制剂活性、丝氨酸型内肽酶抑制剂活性等分子功能类。KEGG分析发现上调和下调蛋白显著富集在补体和凝血级联反应和中性粒细胞胞外陷阱形成等子类中。
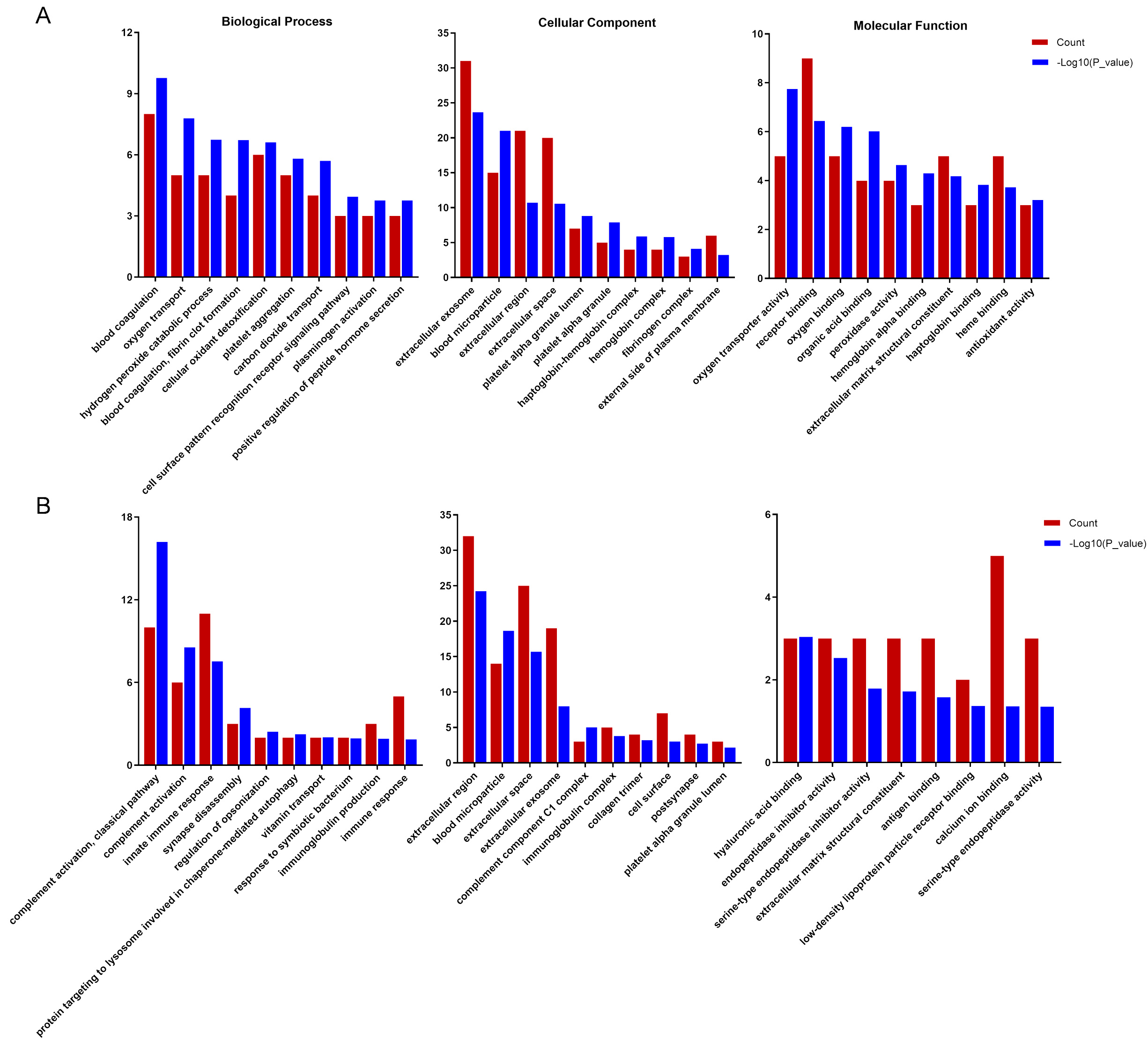
|
| 图 5 上调蛋白(A)和下调蛋白(B)的GO分析 Fig 5 GO analysis of upregulated proteins (A) and downregulated proteins (B) |
|
|
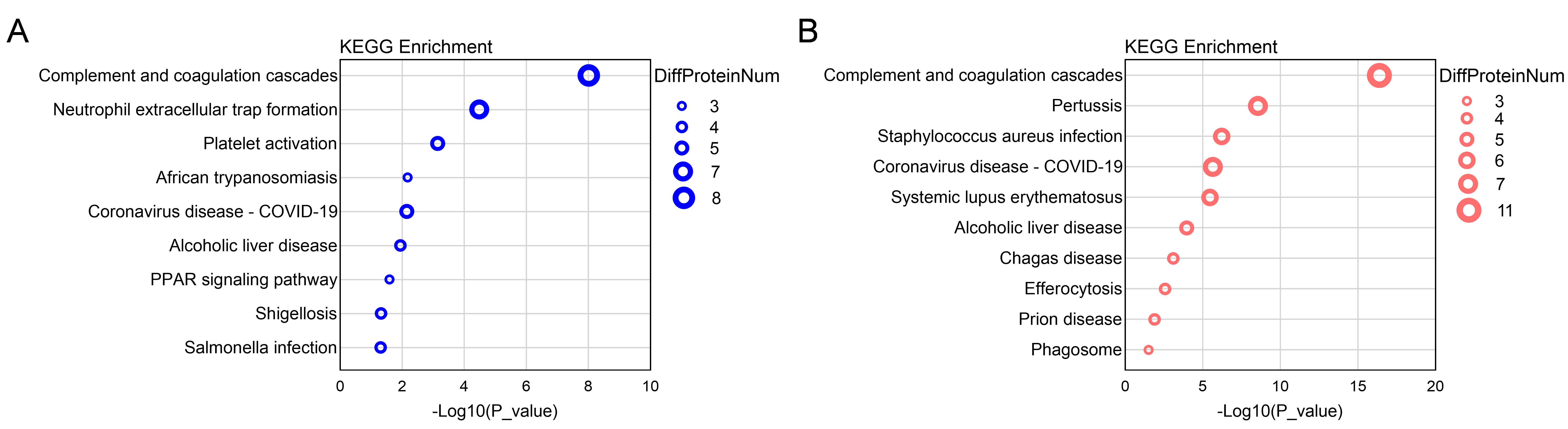
|
| 图 6 上调蛋白(A)和下调蛋白(B)的KEGG分析 Fig 6 KEGG analysis of upregulated proteins (A) and downregulated proteins (B) |
|
|
尽管DQ的毒性相对百草枯较弱,被定义为中等级别,由于缺乏特效解毒剂,救治成功率依然低于其它农药中毒[9]。目前,有关DQ急性中毒的研究尚处于初始阶段,其毒性的具体机制以及临床救治等研究均较少。并且,由于DQ急性中毒的临床样本较难获得,相关研究主要为临床回顾性数据分析或基于动物水平的机制研究[10-11]。回顾性研究发现,中毒剂量、血肌酐值、全身免疫炎症指数等是影响急性DQ中毒患者预后的危险因素;动物实验发现DQ可能通过激活小肠细胞焦亡和降低细胞连接致密性途径损伤肠道。然而,目前鲜有研究报道急性DQ中毒对人体血浆蛋白质表达的影响。
本研究应用基于nanoLC-QTOF-MS的非靶向蛋白质组学技术,首次探究了急性DQ中毒患者的蛋白表达特征,并从分子水平阐明差异表达蛋白参与的生物学过程和相关通路的情况。研究结果表明,急性DQ中毒对患者的血浆蛋白表达影响显著,与健康人的血浆蛋白表达差异明显,共分析得到与DQ毒性相关的76个差异表达蛋白质。功能分析结果表明差异蛋白主要参与补体激活,体液免疫以及凝血反应等过程。值得一提的是,脂联蛋白(ADIPOQ)的表达不仅与DQ中毒相关,与患者预后也密切相关,可以作为DQ中毒以及结局预测的候选标志物。
纤维蛋白原α、β和γ链(Fibrinogen alpha, beta, gamma chain, FGA, FGB和FGG)聚合形成不溶性纤维蛋白原,在血栓形成和稳定中发挥重要作用[12]。据报道,FGA,FGB和FGG的异常表达与肝癌或乳腺癌等多种肿瘤以及慢性阻塞性肺病等密切相关[13-14]。同时,纤维蛋白原也是一种急性期蛋白,在炎症期间,血浆浓度可迅速升高[15]。本研究中,FGA、FGB和FGG是差异表达倍数最高的前三名蛋白,上调倍数高达50倍,强有力的证明这三个蛋白在DQ中毒的急性期,也参与了机体相应的凝血和炎症等生物过程。但是作为急性期蛋白,参与多种疾病的早期阶段,对早期诊疗DQ急性中毒缺乏足够的特异性。
肌红蛋白(myoglobin, MB)是由横纹肌溶解释放的运输和储存氧气的蛋白,具有类似过氧化物酶活性,导致生物分子氧化失控、脂质过氧化和异前列腺素的生成[16]。最近的一项研究发现,高表达的MB可能通过诱导铁死亡参与劳累性中暑导致的急性肾损伤[17]。本研究发现DQ急性中毒患者血浆中MB表达显著升高,可能与DQ中毒引起的氧化应激和早期急性肾损伤有关,但其具体作用机制有待进一步研究。
蛋白S100A8和S100A9(protein S100-A8/A9, S100A8/S100A9)属于S100亚家族的Ca2+结合蛋白,在单核细胞、中性粒细胞、活化的上皮细胞和内皮细胞上高表达,负责调节免疫反应和炎症过程[18]。S100A8和S100A9在许多癌症和炎症状态中也发挥重要作用。在不同癌症中,S100A8和S100A9的表达趋势有所差别,例如在急性髓系白血病或宫颈癌中表达升高,而在食管癌和肾上腺皮质癌中则降低[19]。在炎症状态下,S100A8和S100A9可通过活化的吞噬细胞分泌,并在患有免疫系统疾病的患者中升高[20],说明二者在不同疾病中可能通过不同途径和机制发挥作用。此外,研究也发现S100A8和S100A9在百草枯中毒患者血浆中表达异常升高,可以作为诊断百草枯中毒的潜在生物标志物[21]。与之相似,本研究在急性DQ中毒患者血浆中也发现显著升高的S100A8和S100A9蛋白,侧面证明二者可能在机体对抗农药中毒的生物过程中发挥重要作用。
脂联蛋白(adiponectin, ADIPOQ)是由脂肪组织分泌的调节多种生理功能的内分泌因子,经翻译后修饰可形成不同的多聚体,与受体蛋白结合后启动一系列信号转导事件,如蛋白激酶的磷酸化以及过氧化物酶配体活性的增加等[22-23]。研究显示,ADIPOQ可以刺激骨骼肌的脂肪酸发生氧化反应,从而抑制肝脏中葡萄糖的产生,进而改善全身的能量稳态[24]。此外,ADIPOQ也具有经典的抗炎和抗凋亡作用,可保护心血管系统、肺脏和结肠等[25]。可见,ADIPOQ在体内主要承担保护性作用。本次研究结果发现,ADIPOQ不仅在DQ急性中毒患者血浆中升高,在DQ中毒后死亡的患者血浆中升高更甚,证明预后差的患者在中毒早期的内在环境与预后较好的患者相比已有明显的差别,也提示DQ进入人体后可能从能量稳态,细胞炎症和凋亡等途径攻击各个脏器,可以作为进一步研究DQ毒性机制的切入点。
本研究存在不足之处:整体样本量有限,未来需进一步扩大样本量进行验证;所得差异蛋白的确切表达水平尚不清楚,需要联合其他技术准确定量差异蛋白的表达,为临床应用提供更高的可行性。
综上,本研究应用基于nanoLC-QTOF-MS的非靶向蛋白质组学技术,首次探究了急性DQ中毒患者的蛋白表达特征,不仅分析了与DQ中毒相关的关键蛋白,也发现了对中毒预后有潜在价值的靶标蛋白。初步探索急性DQ中毒与蛋白质组学的内在关联为后续DQ毒性作用机制的深入研究提供新的研究方向,也为中毒患者的诊断和预后提供参考。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张天祺:研究设计、数据处理与分析、论文撰写;杨娜:样本收集、实验操作;王敏:收集数据、统计分析;罗雪梅:病例收集、数据整理;朱怀军:论文指导与修改、统计分析
| [1] | 吴雨璇, 张劲松, 乔莉, 等. 43例成份标注为敌草快的除草剂急性中毒临床观察[J]. 中华急诊医学杂志, 2019, 28(10): 1287-1291. DOI:10.3760/cma.j.issn.1671-0282.2019.10.021 |
| [2] | 张晓凡, 谷玉雷, 朱志强, 等. 敌草快中毒早期危险因素筛选及对预后的预测[J]. 中华急诊医学杂志, 2024, 33(3): 286-290. DOI:10.3760/cma.j.issn.1671-0282.2024.03.004 |
| [3] | 急性敌草快中毒诊断与治疗专家共识组. 急性敌草快中毒诊断与治疗专家共识[J]. 中华急诊医学杂志, 2020, 29(10): 1282-1289. DOI:10.3760/cma.j.issn.1671-0282.2020.10.002 |
| [4] | 张炉英, 陆元兰, 岑祥莹, 等. 敌草快免疫毒性研究进展[J]. 中华急诊医学杂志, 2021, 30(5): 646-650. DOI:10.3760/cma.j.issn.1671-0282.2021.05.027 |
| [5] | Quevillon E, Silventoinen V, Pillai S, et al. InterProScan: protein domains identifier[J]. Nucleic Acids Res, 2005, 33(Web Server issue): W116-W120. DOI:10.1093/nar/gki442 |
| [6] | Chen KY, Tang YH, Lan LH, et al. Autophagy mediated FTH1 degradation activates gasdermin E dependent pyroptosis contributing to diquat induced kidney injury[J]. Food Chem Toxicol, 2024, 184: 114411. DOI:10.1016/j.fct.2023.114411 |
| [7] | Zhang HZ, Zhang JS, Li JQ, et al. Multi-omics analyses reveal the mechanisms of early stage kidney toxicity by diquat[J]. Toxics, 2023, 11(2): 184. DOI:10.3390/toxics11020184 |
| [8] | Wiśniewski JR, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis[J]. Nat Methods, 2009, 6(5): 359-362. DOI:10.1038/nmeth.1322 |
| [9] | Han KS, Kim SJ, Lee EJ, et al. Development and validation of new poisoning mortality score system for patients with acute poisoning at the emergency department[J]. Crit Care, 2021, 25(1): 29. DOI:10.1186/s13054-020-03408-1 |
| [10] | 李素娟, 袁丁, 侯林林, 等. 150例自诉敌草快中毒患者的回顾性临床研究[J]. 中华急诊医学杂志, 2023, 32(9): 1241-1244. DOI:10.3760/cma.j.issn.1671-0282.2023.09.016 |
| [11] | 谢梓萌, 田质光, 赵宁军, 等. 急性敌草快中毒患者预后相关因素分析[J]. 中华急诊医学杂志, 2024, 33(1): 78-83. DOI:10.3760/cma.j.issn.1671-0282.2024.01.013 |
| [12] | Asselta R, Paraboschi EM, Duga S. Hereditary hypofibrinogenemia with hepatic storage[J]. Int J Mol Sci, 2020, 21(21): 7830. DOI:10.3390/ijms21217830 |
| [13] | Feugray G, Billoir P, Casini A, et al. Afibrinogenemia with two compound heterozygous mutations in FGA gene[J]. Haemophilia, 2021, 27(5): e641-e644. DOI:10.1111/hae.14377 |
| [14] | 刘宏军, 顾建军, 高君吟, 等. FGG与FGA在吸烟所致COPD中的表达及意义[J]. 中国病理生理杂志, 2021, 37(10): 1868-1875. DOI:10.3969/j.issn.1000-4718.2021.10.017 |
| [15] | Lissitchkov T, Madan B, Djambas Khayat C, et al. Fibrinogen concentrate for treatment of bleeding and surgical prophylaxis in congenital fibrinogen deficiency patients[J]. J Thromb Haemost, 2020, 18(4): 815-824. DOI:10.1111/jth.14727 |
| [16] | Knochel JP. Rhabdomyolysis and myoglobinuria[J]. Annu Rev Med, 1982, 33: 435-443. DOI:10.1146/annurev.me.33.020182.002251 |
| [17] | Luan YY, Huang EP, Huang JJ, et al. Serum myoglobin modulates kidney injury via inducing ferroptosis after exertional heatstroke[J]. J Transl Int Med, 2023, 11(2): 178-188. DOI:10.2478/jtim-2023-0092 |
| [18] | Fanò G, Biocca S, Fulle S, et al. The S-100: a protein family in search of a function[J]. Prog Neurobiol, 1995, 46(1): 71-82. DOI:10.1016/0301-0082(94)00062-m |
| [19] | Chen Y, Ouyang YZ, Li ZX, et al. S100A8 and S100A9 in cancer[J]. Biochim Biophys Acta BBA Rev Cancer, 2023, 1878(3): 188891. DOI:10.1016/j.bbcan.2023.188891 |
| [20] | Roth J, Vogl T, Sorg C, et al. Phagocyte-specific S100 proteins: a novel group of proinflammatory molecules[J]. Trends Immunol, 2003, 24(4): 155-158. DOI:10.1016/s1471-4906(03)00062-0 |
| [21] | Wei LM, Wang Y, Lin L, et al. Identification of potential serum biomarkers of acute paraquat poisoning in humans using an iTRAQ quantitative proteomic[J]. RSC Adv, 2018, 8(19): 10598-10609. DOI:10.1039/c7ra12956d |
| [22] | Wang Y, Xu AM, Knight C, et al. Hydroxylation and glycosylation of the four conserved lysine residues in the collagenous domain of adiponectin. Potential role in the modulation of its insulin-sensitizing activit[J]. J Biol Chem, 2002, 277(22): 19521-19529. DOI:10.1074/jbc.M200601200 |
| [23] | Yamauchi T, Kamon J, Ito Y, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects[J]. Nature, 2003, 423(6941): 762-769. DOI:10.1038/nature01705 |
| [24] | Yamauchi T, Kamon J, Minokoshi Y, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase[J]. Nat Med, 2002, 8(11): 1288-1295. DOI:10.1038/nm788 |
| [25] | Fang H, Judd RL. Adiponectin regulation and function[J]. Compr Physiol, 2018, 8(3): 1031-1063. DOI:10.1002/cphy.c170046 |
 2025, Vol. 34
2025, Vol. 34




