2. 南京医科大学第一附属医院急诊医学科,南京 210029;
3. 沈阳药科大学药学院,沈阳 117004;
4. 南京医科大学法医学系,南京 210029;
5. 南京大学医学院附属鼓楼医院急诊医学科,南京 210008;
6. 南京医科大学现代毒理学教育部重点实验室,南京 210029
2. Department of Emergency, Jiangsu Province Hospital, The First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China;
3. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 117004, China;
4. Department of Forensic Medicine, Nanjing Medical University, Nanjing 210029, China;
5. Department of Emergency, Nanjing Drum Tower Hospital, Affiliated Hospital of Medical School, Nanjing University, Nanjing 210008, China;
6. The Key Laboratory of Modern Toxicology of Ministry of Education, Nanjing Medical University, Nanjing 210029, China
活性炭作为毒物清除吸附剂已有百年历史,国内外报道了大量有关活性炭在毒物清除中的应用研究[1-3],其中体外实验证明活性炭可以吸附有机磷农药[4]、亚硝酸钠[5]和γ-羟基丁酸[6]等药(毒)物。然而,既往由于国内医用活性炭的缺乏,在临床上没有得到广泛的应用,临床医务人员对其使用方法、疗效和不良反应等了解有限。相反,国外有临床研究表明活性炭在体内可以吸附清除对乙酰氨基酚[7]、玛伐凯泰[8]和卡马西平[9]等药(毒)物。近年来,随着国外活性炭产品进入国内市场,以及国内厂家产品逐步应用于临床,使活性炭在临床应用与推广成为可能,2016年《急性中毒诊断与治疗中国专家共识》[10]建议对于短时间内摄入了有潜在毒性、过量的药物或毒物的患者,可通过口服活性炭进行毒物清除。2018年度美国毒物控制中心协会基于毒物数据系统报告显示抗精神类药物是第二大类致成人中毒药物[11],喹硫平是其中普遍应用的药物之一,活性炭对于此类药物中毒的救治效果尚不明确,而且活性炭在国内其他急性中毒救治中的实际应用仍然有限,限制活性炭应用的主要原因包括活性炭对毒物清除效果的评价没有统一标准[12-13]、活性炭对不同毒物的吸附选择性仍不明确以及活性炭在体内对毒物的清除效果缺少相关报道[14]等。本研究探讨了活性炭在不同条件下对喹硫平的吸附能力,建立了体外和体内的标准评价方法。
1 材料与方法 1.1 实验动物6~8周龄健康雄性SD大鼠,体质量约200 g,由南京医科大学动物实验中心提供,动物许可证号:SYXK(苏)2020-0022。所有动物在温度20~26 ℃、湿度50%~60%的动物房,自由进食、饮水,在每12 h光—暗循环的可控环境中适应饲养1周。在实验前一天禁食12 h,不禁水。本研究中动物实验的操作遵照南京医科大学的动物伦理要求并已获得审批(审批编号:IACUC-2408037)。
1.2 主要试剂喹硫平标准品购于上海阿拉丁生化科技股份有限公司,地西泮-d5标准品购于上海安谱实验科技股份有限公司,活性炭粉末购于河北长天药业有限公司。色谱纯甲醇、乙腈、氨水和乙酸铵,均购于上海安谱实验科技股份有限公司,配置溶液用水为屈臣氏蒸馏水。
1.3 活性炭对喹硫平吸附清除条件优化考察活性炭在不同有机溶剂浓度、体系孵育温度、体系孵育时间及体系的pH等条件下对喹硫平吸附率的影响(表 1)。分别将上述孵育后的溶液在室温(25 ℃)下12 000 r/min离心10 min取100 µL上清液至1.5 mL的EP管中,加100 µL甲醇/乙腈(V/V,1∶1),涡旋1 min,在室温(25 ℃)下12 000 r/min离心10 min取60 µL上清液上机检测。
| 组别 | 有机溶剂浓度 | 孵育温度 | 孵育时间 | pH |
| A组、B组 | 1%~100%的甲醇或乙腈 | 37 ℃ | 30 min | pH7 |
| C组 | 10%甲醇 | 4~57 ℃ | 30 min | pH7 |
| D组 | 10%甲醇 | 37 ℃ | 1 min~60 min | pH7 |
| E组 | 10%甲醇 | 37 ℃ | 30 min | pH2~pH11 |
| F组 | 10%DMSO、甲醇或乙腈 | 37 ℃ | 30 min | pH7 |
配制含10%甲醇的1 µg/mL喹硫平溶液,分别配制浓度为0.0005 mg/mL,0.005 mg/mL,0.05 mg/mL,0.5 mg/mL,5 mg/mL,50 mg/mL的活性炭水溶液。建立体外孵育体系,取150 μL喹硫平溶液(1 µg/mL)加入1.5 mL的EP管中,分别加入不同浓度活性炭水溶液50 μL (0.0005 mg/mL,0.005 mg/mL,0.05 mg/mL,0.5 mg/mL,5 mg/mL,50 mg/mL),将EP管置于37 ℃加热震荡金属浴中,转速600 r/min,孵育30 min,取上述溶液,12 000 r/min离心10 min取100 µL上清液至1.5 mL的EP管中,加100 µL甲醇/乙腈(V/V,1∶1),涡旋1 min,12 000 r/min离心10 min,取60 µL上清液上机检测,计算喹硫平的吸附率,吸附率=(吸附前喹硫平浓度−吸附后喹硫平浓度)/吸附前喹硫平浓度。通过Origin 2021软件进行函数拟合建立模型。
1.5 体内动物试验分组及处置按随机数字表法将12只大鼠分为对照组和实验组2组,每组6只。两组大鼠分别灌胃配制好的50 mg/kg喹硫平溶液1 mL,灌胃10 min后,对照组灌胃1 mL纯净水,实验组灌胃1 mL浓度125 mg/mL的活性炭水溶液。两组大鼠分别在给药前、给药后0.17 h, 0.33 h, 0.50 h, 0.75 h, 1 h, 1.5 h, 2 h, 4 h, 6 h, 12 h以及24 h于眼眶内取血200 μL,置于含有EDTA的EP管中,混匀,12 000 r/min离心10 min,分离血浆置于-80 ℃中保存待测。
1.6 血浆样品的前处理从-80 ℃冰箱拿出待测血浆,室温下解冻,取20 μL大鼠血浆,加入20 μL内标(地西泮-d5,0.1 μg/mL)和80 μL甲醇/乙腈(V/V,1∶1),涡旋1 min,12 000 r/min离心10 min,取60 μL上清液经0.22 μm有机相滤膜过滤,上机检测。
1.7 喹硫平浓度测定方法采用高效液相色谱-串联质谱(XEVO TQ-S micro, Waters)对生物样品中喹硫平浓度进行测定。液相色谱条件:采用ACQUITY BEH C18色谱柱(1.7 μm, 2.1 mm×50 mm),柱温40 ℃,体积流量为0.35 mL/min。流动相:A相为20 mmol乙酸铵水溶液(含0.1%甲酸),C相为乙腈。等度洗脱:A∶C=45∶55。进样量:5 μL。质谱条件:在正离子模式下,采用ESI离子源,Source Voltages Capillary 2.0 kV,Desolvation Temp 500 ℃。采用MRM模式进行监测。
1.8 统计学方法采用SPSS 27.0软件对数据进行统计学处理。用Origin 2021软件进行函数拟合,血药浓度数据采用DAS 2.0软件计算药代动力学参数。GraphPad Prism 9.0软件作图。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 方法专属性及标准曲线在液相色谱-质谱联用条件下,喹硫平色谱图峰形良好(图 1),喹硫平和内标地西泮-d5的保留时间分别为0.62 min和0.81 min,生物样品中内源性物质与目标性成分无干扰,检测方法具有良好的专属性。对于血浆样本,该方法在1~1 000 ng/mL浓度范围内线性关系良好(y=0.2126x+1.0854,R2=0.9997)(图 2)。
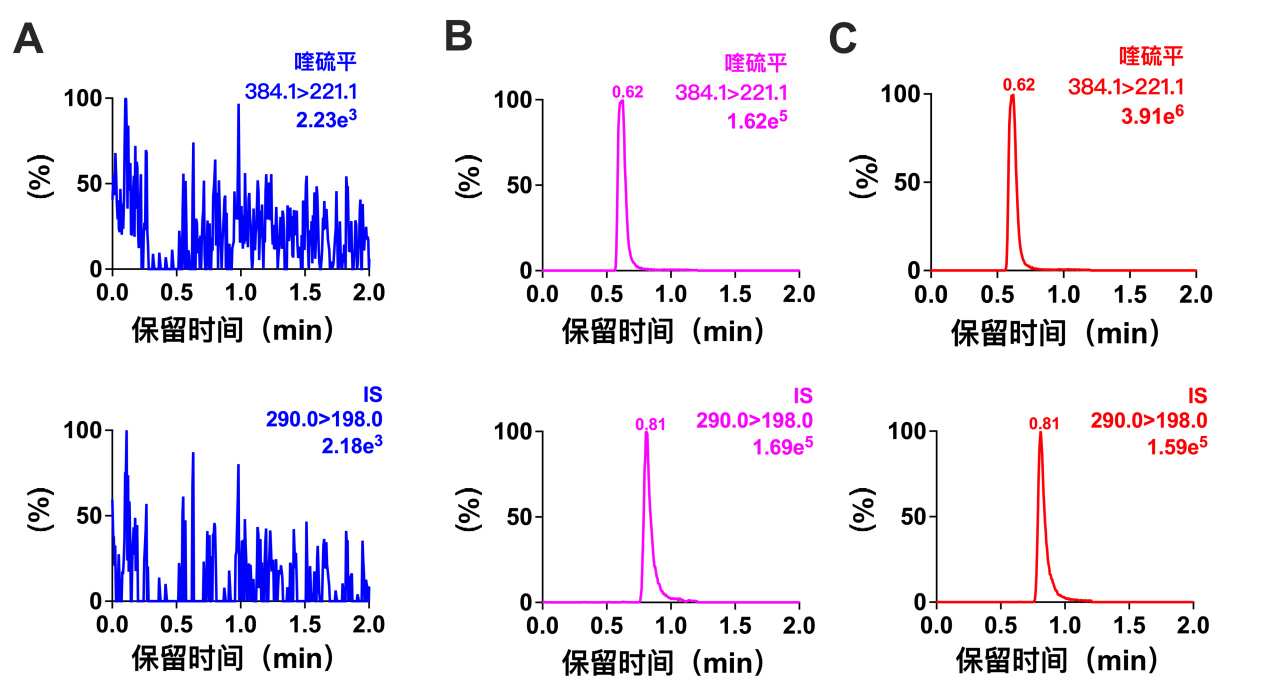
|
| 注:A空白血浆;B空白血浆中添加定量下限的喹硫平;C大鼠真实血浆样品 图 1 大鼠血浆中喹硫平与IS的MRM色谱图 Fig 1 Typical multiple reaction monitoring chromatograms of quetiapine and IS in rat plasma |
|
|
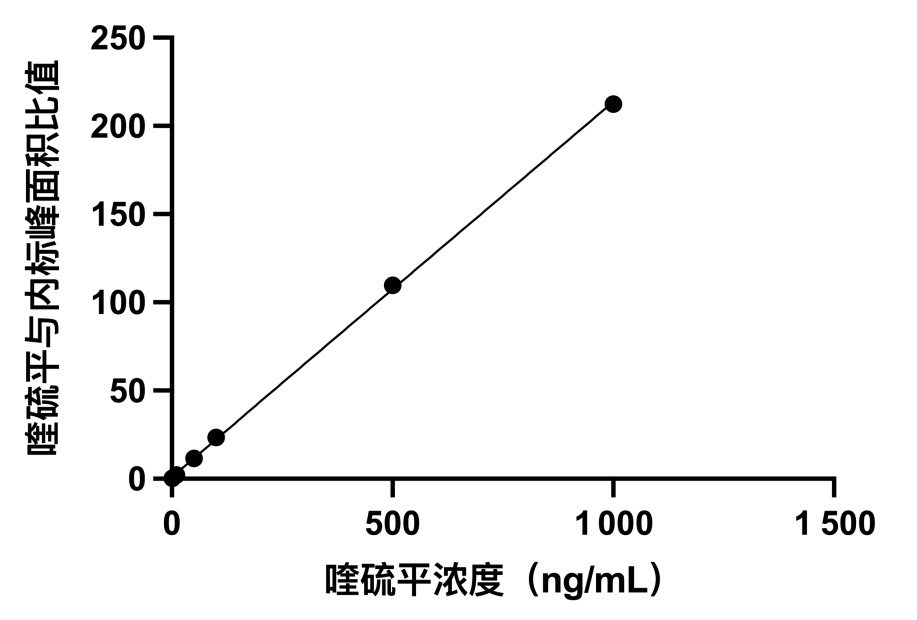
|
| 图 2 喹硫平在血浆样本中1~1 000 ng/mL的浓度范围内线性关系 Fig 2 Linearity of quetiapine in plasma samples in the concentration range of 1-1 000 ng/mL |
|
|
通过检测活性炭在不同条件下对喹硫平的吸附率(图 3),实验结果显示随着有机溶剂浓度的升高,活性炭对其吸附率下降。乙腈对吸附率的影响比甲醇更明显(图 3A, B),当甲醇浓度超过10%,吸附率显著下降,为了兼顾喹硫平的溶解度,最终选择10%的甲醇做为溶剂。不同的温度对活性炭的吸附率也会产生影响(图 3C),最终选择接近于体内的37℃作为孵育体系的温度,随着活性炭吸附时间的延长,活性炭在体外30 min时吸附达到饱和(图 3D);除此之外不同的pH值也会对活性炭吸附产生影响(图 3E),但在相同浓度的不同有机溶剂中活性炭对喹硫平的吸附基本相同(图 3F)。
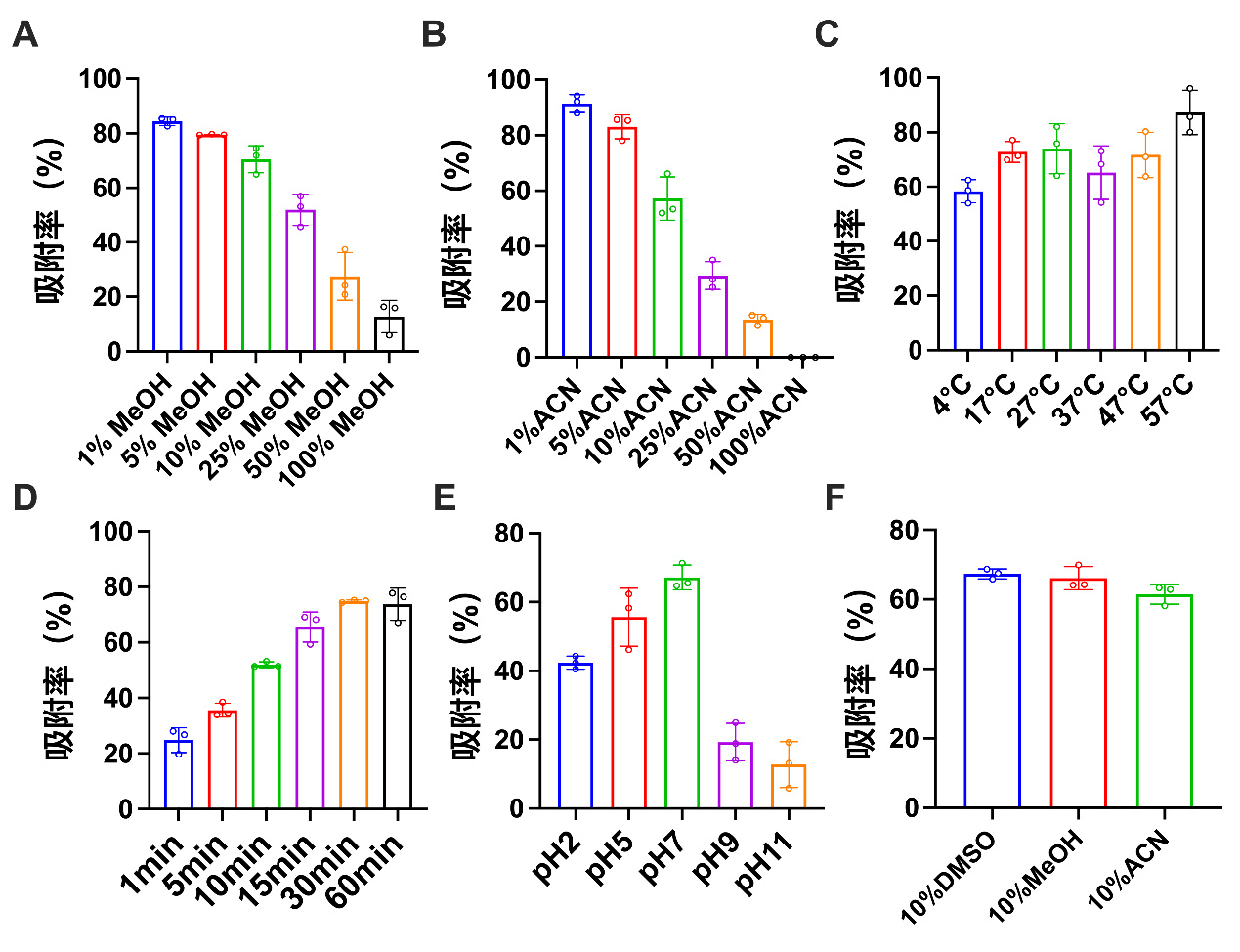
|
| 图 3 在不同条件下活性炭对喹硫平的吸附率 Fig 3 Adsorption rate of quetiapine by activated carbon under different conditions |
|
|
配制含10%甲醇浓度为1 µg/mL的喹硫平溶液,在37 ℃的孵育条件下,考察不同浓度活性炭(0.0005 mg/mL,0.005 mg/mL,0.05 mg/mL,0.5 mg/mL,5 mg/mL,50 mg/mL)对喹硫平的吸附效果,计算吸附率。以log10的活性炭浓度作为自变量,吸附率作为因变量,在Origin 2021软件中进行函数拟合,通过拟合100个函数模型,最终筛选出回归相关系数前16的函数拟合模型(图 4)及函数拟合相关数值(表 2),其中Boltzmann模型的评分最高,为最优模型。
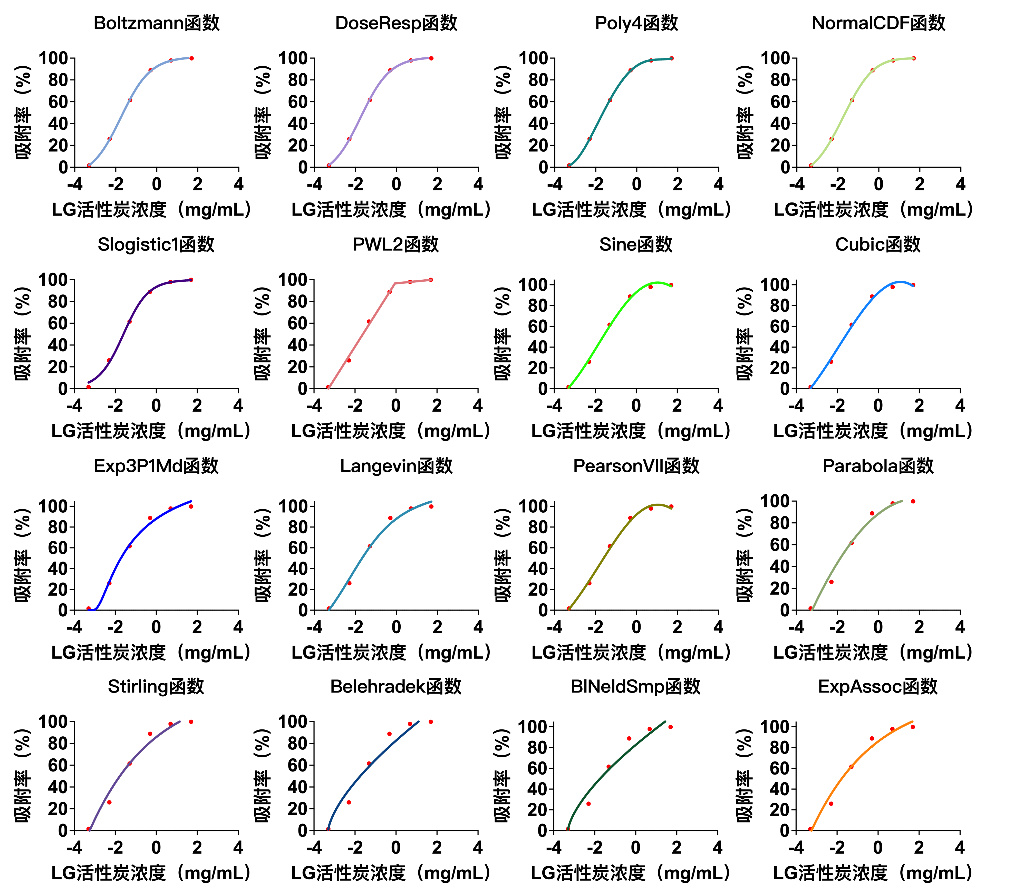
|
| 图 4 活性炭在体外吸附喹硫平的函数拟合模型 Fig 4 Function-fitting modeling of quetiapine adsorption by activated carbon in vitro |
|
|
| 模型名称 | 方程 | Reduced Chi-Sqr | R平方(COD) | 调整后R平方 |
| Boltzmann | y=A2+(A1-A2)/(1+exp((x-x0)/dx)) | 0.9811 | 0.9998 | 0.9994 |
| DoseResp | y= A1 +(A2-A1)/(1 +10^((LOGx0-x)*p)) | 0.9759 | 0.9998 | 0.9994 |
| Poly4 | y=A0+A1*x+A2 *x^2 + A3 *x^3 + A4*x^4 | 0.4960 | 0.9999 | 0.9997 |
| NormalCDF | y=y0+ A*normcdf((x-xc)/w) | 0.1523 | 1.0000 | 0.9999 |
| Slogistic1 | y = a/(1 + exp(-k*(x-xc))) | 7.269 | 0.9974 | 0.9957 |
| PWL2 | double yi;yi = a1+k1* xi; if(x<xi), y=a1+ k1*x; | 10.54 | 0.9975 | 0.9937 |
| Sine | y=y0+ A*sin(pi*(x-xc)/w) | 11.76 | 0.9972 | 0.9930 |
| Cubic | y=A+B*x + C*x^2+D*x^3 | 16.75 | 0.9960 | 0.9900 |
| Exp3P1Md | y =exp(a + b/(x + c)) | 20.38 | 0.9927 | 0.9878 |
| Langevin | y=y0 +C*(cothz-1/z) | 25.32 | 0.9909 | 0.9849 |
| PearsonⅦ | y=y0+A*2 * gamma(m)*sqrt(2^(1./m)-1)/(sqrt(pi)*w*gamma(m-0.5)) *(1.+ 4.*(2^(1./m)-1)/w^2 * (x-xc)^2)^(-m) | 30.19 | 0.9964 | 0.9820 |
| Parabola | y=A+B*x+C*x^2 | 38.62 | 0.9862 | 0.9770 |
| Stirling | y=a + b*(exp(k*x)-1)/k | 63.70 | 0.9772 | 0.9620 |
| Belehradek | y = a*(x-b)^c | 120.8 | 0.9568 | 0.9280 |
| BlNeldSmp | y= (a + b*x)^(-1/c) | 120.8 | 0.9568 | 0.9280 |
| ExpAssoc | y= y0 + A1*(1-exp(-x/t1)) +A2*(1-exp(-x/t2)) | 191.1 | 0.9772 | 0.8860 |
通过测定对照组和实验组大鼠不同时间点血浆喹硫平浓度,绘制药物浓度-时间曲线(图 5)。采用DAS 2.0软件计算两组的药代动力学参数(表 3),计算血浆中喹硫平的峰浓度、消除半衰期、平均滞留时间、表观清除率、曲线下面积等药代动力学参数。对照组和实验组在约在0.5 h达峰,实验组的AUC (229.9±57.2) ng/(mL·h)与对照组的AUC (727.8±290.1) ng/(mL·h)相比明显降低(P=0.008),实验组的Cmax(102.5±50.5)ng/mL与对照组的Cmax(311.0±188.2)ng/mL相比明显降低(P=0.041),两组数据差异有统计学意义。
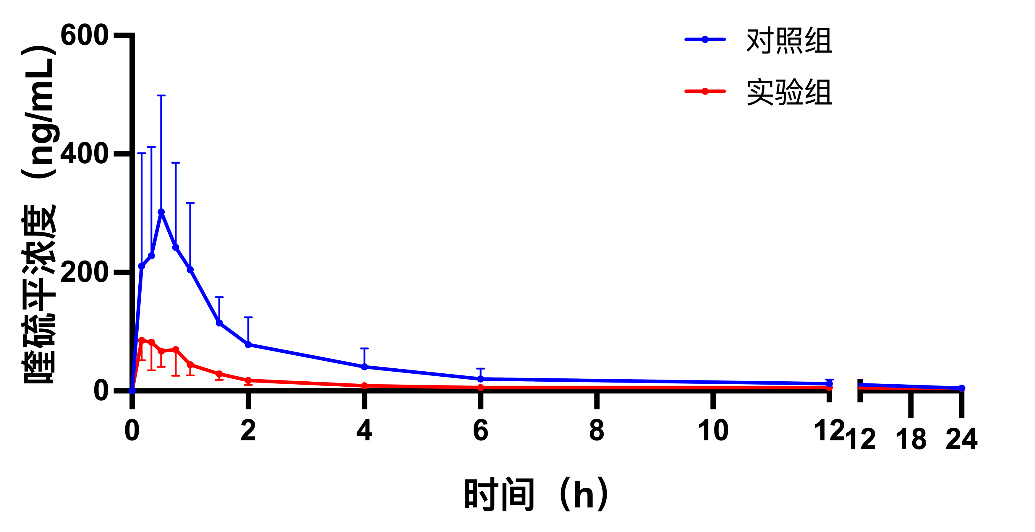
|
| 图 5 给药后对照组和实验组喹硫平的平均血药浓度-时间曲线 Fig 5 Mean blood concentration-time curves of control and activated charcoal groups after quetiapine via gavage |
|
|
| 药代动力学参数 | 对照组 | 实验组 | 统计值 | P值 |
| AUC 0-t (ng/mL·h) | 727.8±290.1 | 229.9±57.2 | 4.124a | 0.008 |
| Tmax(h) | 0.597±0.238 | 0.514±0.266 | 0.560b | 0.620 |
| Cmax(ng/mL) | 311.0±188.2 | 102.5±50.5 | 2.621a | 0.041 |
| t1/2(h) | 6.64±4.17 | 8.65±2.01 | 1.254a | 0.238 |
| MRT 0-t(h) | 5.01±2.02 | 6.47±2.34 | 1.155a | 0.275 |
| CL(L/kg·h) | 0.073±0.030 | 0.193±0.706 | 2.621a | 0.041 |
| 注:AUC(Area Under the Concentration-time Curve)药时曲线下面积,Tmax (Time at which the maximum concentration is observed)达到最大血浆浓度的时间,Cmax (Maximum concentration observed)最大血浆浓度,t1/2 (Terminal phase half-life)药物浓度降低到一半所需的时间,MRT(Mean Residence Time)平均滞留时间,CL(Clearance)清除率;a为行t检验,b为行U检验 | ||||
在临床急性中毒涉及的毒物种类众多,目前已报道能够被活性炭吸附的毒物种类仍然有限[2]。因此,对于许多缺少活性炭吸附有效证据的毒物,是否使用活性炭仍是困扰一线医生的一大难题。根据一项多中心[15]统计表明在临床急性中毒中药物中毒占比约40%,其中精神类药品占比60%,组内占比最高。喹硫平是最常用的第二代抗精神病药物之一,目前在误服和口服自杀等事件中呈现日益增长的趋势[16-17]。课题组以喹硫平为实验毒(药)物模型,在体外环境下考察了活性炭在不同溶媒浓度、吸附温度、吸附时间、溶媒pH值以及活性炭浓度等因素对喹硫平吸附清除的影响,结果表明以上因素都会影响活性炭吸附效果。国外一项研究[18]表明活性炭在不同pH环境下对药物的吸附没有明显的变化,但是此研究只探究了一个活性炭的浓度,不能排除各实验条件下,活性炭对药物的吸附处于一个过饱和状态。后续的研究证明了这一点,在不同pH环境下活性炭对于毒物的吸附率不同[6, 19-20],本团队的研究结论与之保持一致。因此,优化实验标准是评价活性炭对毒物吸附清除效果的重要条件。
目前活性炭对不同毒物吸附效果缺少统一的评价标准,难以比较活性炭对不同毒物吸附作用的强弱。本研究通过不同浓度的活性炭吸附喹硫平标准溶液,计算活性炭吸附率,将吸附率进行函数模型拟合,拟合了100个函数模型,最终筛选出拟合度排名前16个函数模型。其中8个拟合函数相关系数大于0.99,根据简化卡方统计得出Boltzmann函数拟合效果最优。Boltzmann函数模型是描述粒子在热力学平衡状态下的能量分布规律,而活性炭吸附毒物过程的本质上是毒物分子与活性炭表面之间的相互作用(如范德华力、静电作用等)的结果,结合本实验表明活性炭吸附毒物的过程最终会趋近吸附平衡。同时,温度因素在Boltzmann函数中也起到关键作用,这与图 3C结果保持一致。Boltzmann函数为理解活性炭吸附毒物的能量分布、温度依赖性和吸附平衡提供了理论基础,帮助优化吸附条件(如温度控制)并预测吸附能力。同时随着活性炭的浓度增加,对喹硫平吸附量也逐渐增加并趋于饱和状态,说明在一定条件下,活性炭表面的吸附位点有限,达到饱和后其吸附能力不再增加,存在吸附饱和现象。笔者在Boltzmann函数模型中定义了半百分吸附浓度(Concentration for 50% of absorbtion rate, AR50)来评价活性炭对毒物吸附清除效果,即1 μg/mL毒物体系中,吸附50%毒物所需的活性炭浓度。毒物AR50值的大小反映出活性炭对其吸附能力的大小,通过测定不同毒物的AR50值,可以实现活性炭对不同毒物吸附作用大小的比较。结合药物代谢动力学参数的改变在大鼠体内评价活性炭对药(毒)物吸附清除效果,
此外,本研究通过测定活性炭组和对照组大鼠血浆中喹硫平的浓度,绘制药时曲线并计算药物代谢动力学参数。实验结果表明活性炭组的AUC约降低500 ng/(mL·h),Cmax约降低200 ng/mL,与对照组相比AUC和Cmax明显降低,这与体外实验活性炭对喹硫平具有吸附效果的结果一致。有一项临床研究显示在54例不同的药物过量患者中,19例患者在摄入后3 h(范围0.5~6.0 h)服用50g活性炭,群体药代动力学模型显示,活性炭使喹硫平的生物利用度降低了35%[21]。喹硫平的Tmax约在0.5 h左右,上述的临床研究主要是考察了喹硫平吸收Tmax后活性炭的吸附效果。另有研究[8, 22]评估了在Tmax前后使用活性炭对药物清除的影响,结果表明在Tmax前后使用活性炭的吸附消除效果存在差异。本文研究的大鼠是在灌胃喹硫平后10 min后给予的活性炭,考察了Tmax前使用活性炭对喹硫平的清除效果。后续研究将进一步比较不同胃内容物以及Tmax前后使用活性炭对喹硫平清除效果的影响。
缺少活性炭对毒物实际清除效果的评价方法是目前限制活性炭推广使用的重要因素之一。本研究通过拟合函数模型构建了活性炭对喹硫平的吸附率评价方法,通过毒代动力学参数评价活性炭在大鼠体内对喹硫平的吸附效果,体内和体外实验结果均表明活性炭对喹硫平具有明显的吸附消除效果,这为活性炭在临床喹硫平中毒治疗中的应用提供了重要参考。尽管本研究验证了活性炭在体内、外对喹硫平的吸附效果,但仍存在一些局限性。体外模型仅通过喹硫平的数据进行函数拟合,后续需要更多活性炭体外吸附药(毒)物的数据进行函数模型的验证。此外,本研究没有涉及喹硫平与其它药物并存时对活性炭吸附效果的影响。活性炭在临床中的应用尚有争议[23-24],许多因素决定了活性炭在口服药物中毒中的有效性。从服药到使用活性炭的时间、活性炭类型、使用量、活性炭与服用药物的比例、胃肠道的酸度、胃肠道含量、服用药物的类型、服用药物量、个人合并症和活性炭引起的并发症是可能影响结果变量的因素[25]。
综上所述,本研究首次建立了以活性炭在体外的吸附率为模型联合动物体内毒代动力学研究,评价活性炭在体内和体外的吸附效果。未来随着研究的深入,课题组将会把更多毒物纳入模型,完善活性炭对毒物吸附清除效果评价标准体系,构建毒物AR50数据库。通过Cmax和AUC等药(毒)代动力学参数与不同AR50数值毒物关联分析,探明活性炭对不同毒物选择性吸附清除规律,为活性炭在中毒救治中的应用提供参考依据。
利益冲突 所有作者声明无利益冲突
作者贡献声明 巴根:论文撰写、实验操作;曹德才、石齐芳、张孛妍:数据收集、整理和分析;谢未然:样本处理;毛征生:提供研究经费、研究设计、论文修改;张劲松、孙昊:文章指导
| [1] | Zellner T, Prasa D, Färber E, et al. The use of activated charcoal to treat intoxications[J]. Dtsch Arztebl Int, 2019, 116(18): 311-317. DOI:10.3238/arztebl.2019.0311 |
| [2] | Hoegberg LCG, Shepherd G, Wood DM, et al. Systematic review on the use of activated charcoal for gastrointestinal decontamination following acute oral overdose[J]. Clin Toxicol (Phila), 2021, 59(12): 1196-1227. DOI:10.1080/15563650.2021.1961144 |
| [3] | 高宁, 卜龙利, 刘嘉栋, 等. 颗粒活性炭对水中典型医药类物质的吸附特性[J]. 环境工程学报, 2016, 10(8): 4289-4297. DOI:10.12030/j.cjee.201503145 |
| [4] | 韩梅, 马瑞风, 梁喜凤, 等. 不同剂型活性炭对有机磷杀虫剂的吸附性能比较体外实验[J]. 河北医药, 2010, 32(8): 923-925. DOI:10.3969/j.issn.1002-7386.2010.08.011 |
| [5] | 王明良, 张宏顺, 孟聪申, 等. 活性炭对亚硝酸钠中毒疗效的实验研究[J]. 中国工业医学杂志, 2008, 21(3): 148-150. DOI:10.3969/j.issn.1002-221X.2008.03.003 |
| [6] | Neijzen R, van Ardenne P, Sikma M, et al. Activated charcoal for GHB intoxication: an in vitro study[J]. Eur J Pharm Sci, 2012, 47(5): 801-803. DOI:10.1016/j.ejps.2012.09.004 |
| [7] | Yeates PJ, Thomas SH. Effectiveness of delayed activated charcoal administration in simulated paracetamol (acetaminophen) overdose[J]. Br J Clin Pharmacol, 2000, 49(1): 11-14. DOI:10.1046/j.1365-2125.2000.00107.x |
| [8] | Merali S, Chiang MT, Sychterz C, et al. Effect of activated charcoal on mavacamten pharmacokinetics in healthy participants[J]. Am J Cardiovasc Drugs, 2024, 24(4): 569-575. DOI:10.1007/s40256-024-00659-z |
| [9] | Brahmi N, Kouraichi N, Thabet H, et al. Influence of activated charcoal on the pharmacokinetics and the clinical features of carbamazepine poisoning[J]. Am J Emerg Med, 2006, 24(4): 440-443. DOI:10.1016/j.ajem.2005.12.025 |
| [10] | 中国医师协会急诊医师分会, 中国毒理学会中毒与救治专业委员会. 急性中毒的诊断与治疗专家共识[J]. 中华卫生应急电子杂志, 2016, 2(6): 333-347. DOI:10.3877/cma.j.issn.2095-9133.2016.06.002 |
| [11] | Gummin DD, Mowry JB, Spyker DA, et al. 2018 Annual Report of the American Association of Poison Control Centers' National Poison Data System (NPDS): 36th Annual Report[J]. Clin Toxicol (Phila), 2019, 57(12): 1220-1413. DOI:10.1080/15563650.2019.1677022 |
| [12] | 王明良, 孙承业. 033活性炭对胃肠道毒物吸附效能的研究现状[J]. 国外医学(卫生学分册), 2008, 35(3): 139-142. |
| [13] | 梁正定, 何永芹. 活性炭混悬液洗胃对急性有机磷农药中毒疗效的meta分析[J]. 国际医药卫生导报, 2021, 27(14): 2062-2066. DOI:10.3760/cma.j.issn.1007-1245.2021.14.002 |
| [14] | 薛祥, 孙兆瑞, 聂时南. 急性中毒诊治进展和面临的挑战[J]. 中华急诊医学杂志, 2024, 33(3): 276-280. DOI:10.3760/cma.j.issn.1671-0282.2024.03.002 |
| [15] | 夏振瑜, 毛征生, 张劲松, 等. 毒物检测技术在895例临床中毒患者中的应用价值研究[J]. 中华急诊医学杂志, 2023, 32(2): 186-191. DOI:10.3760/cma.j.issn.1671-0282.2023.02.010 |
| [16] | ŠošaI. Quetiapine-related deaths: in search of a surrogate endpoint[J]. Toxics, 2024, 12(1): 37. DOI:10.3390/toxics12010037 |
| [17] | 刘亮亮, 张丽丽, 蔡湘龙, 等. 急性喹硫平中毒的现状及研究进展[J]. 临床急诊杂志, 2022, 23(4): 294-298. DOI:10.13201/j.issn.1009-5918.2022.04.015 |
| [18] | Bailey DN, Briggs JR. The effect of ethanol and pH on the adsorption of drugs from simulated gastric fluid onto activated charcoal[J]. Ther Drug Monit, 2003, 25(3): 310-313. DOI:10.1097/00007691-200306000-00011 |
| [19] | Valente Nabais JM, Ledesma B, Laginhas C. Removal of amitriptyline from simulated gastric and intestinal fluids using activated carbons[J]. J Pharm Sci, 2011, 100(12): 5096-5099. DOI:10.1002/jps.22757 |
| [20] | 钟加菊, 姚群梅, 唐燕, 等. 活性炭对鹅膏毒肽及鬼笔毒肽的体外吸附研究[J]. 中国急救医学, 2021, 41(8): 709-713. DOI:10.3969/j.issn.1002-1949.2021.08.012 |
| [21] | Isbister GK, Friberg LE, Hackett LP, et al. Pharmacokinetics of quetiapine in overdose and the effect of activated charcoal[J]. Clin Pharmacol Ther, 2007, 81(6): 821-827. DOI:10.1038/sj.clpt.6100193 |
| [22] | Wang XL, Mondal S, Wang J, et al. Effect of activated charcoal on apixaban pharmacokinetics in healthy subjects[J]. Am J Cardiovasc Drugs, 2014, 14(2): 147-154. DOI:10.1007/s40256-013-0055-y |
| [23] | Elder GM. Activated charcoal: to give or not to give?[J]. Int Emerg Nur, 2010, 18(3): 154-157. DOI:10.1016/j.ienj.2009.10.005 |
| [24] | Ghannoum M, Roberts DM. Management of Poisonings and Intoxications[J]. Clin J Am Soc Nephrol, 2023, 18(9): 1210-1221. DOI:10.2215/CJN.0000000000000057 |
| [25] | Aksay E, Kaya A, Gulen M, et al. Activated charcoal and poisoning: is it really effective?[J]. Am J Ther, 2021, 29(2): e182-e192. DOI:10.1097/MJT.0000000000001422 |
 2025, Vol. 34
2025, Vol. 34




