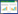2. 首都医科大学附属北京安贞医院北京朝阳医院急诊,北京,100020
心搏骤停(Cardiac Arrest, CA)患者存活基于多个因素,如是否及时高质量CPR、及时除颤、高级生命支持、复苏后的综合管理及医疗机构对复苏质量的重视程度等[1]。AHA关注CPR过程中的质量并推荐的按压速度100~120次/min、深度5~6 cm、确保胸廓充分回弹、减少停顿(减少中断)、避免过度通气,看似简单易操作的BLS手段,事实上绝非想象中的那么简单。本文将从以下几个方面阐述,启发临床医生在实践中学会思辨而非机械执行。
1.1 国内多位专家对CPR相关环节反复强调但依然没有得到足够的重视当谈到高质量心肺复苏(cardiopulmonary resuscitation, CPR)时,或许急诊医务人员可以说的非常流利、培训考试可以高分过关。但是,仔细观察实际工作中真正的达标率少的令人嘘唏。单就CA患者的施救,瞬间可以提供的最有效BLS仍然是任何技术不可替代的复苏手段。且不谈现有的BLS(深度、频率、间隔时间等)在不同病种、不同年龄、不同病理生理状态的CA中存在着极大的局限性[1],在执行指南推荐的BLS为什么会出现如此大的出入,究其原因是没有从根本上理解推荐CPR中BLS方法的幕后原因,因而对临床实际工作中出现的不应该发生的现象“熟视无睹”或“习以为常”或者“无奈”。同时,对CPR过程中带来的潜在继发损害没有足够的认知,导致在诊断CA原发病时出现巨大偏差。
二十年来国内教授在CPR中重点环节不停呼吁似乎并未得到足够的重视:李春盛教授早在2005年对CPR目标与影响成功因素就有明确的阐述[2-3]。成人CPR的研究进展中谈到了CPR过程中按压与通气、避免过度换气、人工气道与简易呼吸器、肾上腺素等措施的利与弊。王立祥教授提出的CPR应该个性化,应“适时、因地、对因”、考虑“病因、群体、条件”及经胸按压存在禁忌时的腹部提压技术[4-5],以及强调CPR中应该避免“刻板化、死腔化、形式化、概念化、无声化及教条化”的理念[6]CPR“概念化及教条化”是ABC还是CAB?等[5]。时至今日,依然没有得到足够的认知。
1.2 与欧美国国家相比,我国CPR恢复ROSC及神经功能保留率存在差距背后的原因剖析来自AHA心脏病和中风数据(-2021年更新)显示[7]:成人院外CA(out-of-hospital cardiac arrest,OHCA)发生率在2015年高达约350, 000,存活出院率10.5% (CARES 2019),其中8.5% 的患者保存较好的神经系统功能(CARES 2019)。美国数据显示每年约有29万人口发生院内CA(in hospital cardiac arrest, IHCA),约占总住院人数的1%~2%,最终存活出院率26.7%,其中80.3%为有较好的神经系统功能。而来自我国40家医院的资料显示存活出院率只有9.4%,神经系统功能恢复6.7%[8]。数据显示,OHCA和IHCA存在可除颤心律比例分别为5%和15.6%。邵菲等通过前瞻性研究收集北京地区12家三级和二级医院10198例CA患者,旨在评估12个月期间IHCA的发生率和预后。研究显示,IHCA发生率为17.5人/1000人,2 712人(26.6%)进行了急救复苏。ROSC占35.5%,出院存活率占9.1%;神经系统功能良好占6.4%[9]。同时,该团队的另一项来自5016例OHCA患者随访5年(2013—2017年)的研究显示,ROSC几率有所增加。分析与公众教育,AED配置等措施有关;同时发现旁观者行CPR由2013年的10.41%升至2017年的19.36%;存活率未见到显著性变化;连续5年的存活出院率分别为2013年的1.2%和2017年的1.6%;可除颤心率由2013年的6.5% 降至2017年的5.6%[10]。究其原因,OHCA存在着诸多的影响因素,如CA没有人敢救、敢救不知怎么救、除颤仪无处可寻、专业人员到位慢、复苏质量不够高、以及后续治疗欠规范等。遗憾的是,IHCA患者CPR中也不尽人意,仍然存在多种不能实现高质量CPR的因素,尤其是不能充分确保胸廓回弹、各种原因的中断(如不必要的脉率(律)分析、不准确的复苏板放置方式;医疗干预中如电除颤、气管插管及机械通气、医护人员切换、动静脉穿刺及用药等)、搬动患者等多个环节导致CPR中断超过10 s。上述任何一项低质量的CPR均会大大降低了CA患者的转归。研究显示CPR施救每延迟一分钟,ROSC和住院的几率降低5%,存活到出院的几率降低12%[11],足以证实了第一时间高质量CPR的重要性。
2 CPR期间CA患者因存在不同病理生理机制而表现出来的复杂泵机制学说有理由推测不同病理生理状态下,实施同一标准CPR难以实现理想的效果。研究发现CPR过程中存在多种泵机制学说,如心泵、胸泵、心房泵、呼吸泵等学说,甚至存在CPR复苏初期及后期泵功能机制的转化。如CPR初期同时参与的心泵和胸泵机制,随着CPR时程延长,胸泵在CPR后期逐渐占主导位置[12-13]。很显然基于目前的证据,一个单一的理论可能不足以解释每个患者在CPR中正向血流的发展和维持。心泵理论和胸泵理论似乎更有说服力,可能分别代表了CPR初始和晚期的主要机制。导致CA的原因很多,差异性极强,如存在年龄、体块指数、胸廓顺应性、人工通气与否、心室顺应性、从CA到高质量CPR时间、气道阻力、存在基础心脏瓣膜病等均可影响主要泵机制的启动情况。每种机制对CPR效率的相对贡献取决于临床和病理生理因素之间复杂的相互作用[13]。
2.1 有效按压与胸廓充分回弹的内涵及其潜在机制按压时来自胸骨与脊椎骨之间对心脏的施压,随着胸腔压力的变大,左心室收缩,二尖瓣关闭及主动脉开放进而导致血流泵出心脏以满足重要脏器的血供。此时静脉瓣的作用不会出现胸腔内静脉系统的血流倒流到腔静脉中(传统意义的收缩期,该机制的前提是将右心-肺循环-左心房视为一个管道),此阶段可以视同为心泵机制。当按压结束后,强调胸廓充分回弹类似于传统意义的舒张期,此时导致心室舒张的动力系统源于胸廓回弹,类似于自主呼吸的吸气过程(此阶段可视同胸泵机制)。随着胸廓回弹的过程胸腔负压增加、胸腔内血管处于舒张或者被动牵拉状态,主动脉瓣关闭等机制导致更多静脉血回至心脏。同时,强调胸廓充分回弹的另一个意义在于冠状动脉供血源于心脏的舒张期,充分回弹允许更长的冠脉供血时间。基于导致心源性CA中常见急性冠脉综合征,充分的回弹与有效按压具有同等价值的理论基础自然而然显现出来(图 1所示)。
|
| 图 1 经胸按压与胸廓回弹时胸腔压力变化与器官灌注模式图(引自医脉通) |
|
|
CPR减压期胸壁不完全回弹会增加胸腔内压(intrathoracic pressure, ITP)和右心房压(right atrial pressure, RAP),阻碍静脉回流,导致平均动脉压、冠状动脉灌注压(coronary perfusion pressure, CPP)和脑灌注压(cerebral perfusion pressure, CerPP)降低。一项9例室颤动物(猪)模型[14],采用自动压缩/减压装置按压频率100次/min,按压/通气比为15:2。研究共采用三步:第一步为标准CPR 3 min;第二步为1 min CPR,按压幅度降为标准幅度的75%(频率不变);第三步恢复1 min标准CPR。研究通过舒张压(主动脉(Ao)-右心房(RA)压)计算冠状动脉灌注压(CPP)。采用多种方法综合计算脑灌注压(CerPP):(1)主动脉压与颅内压(ICP)波形之间的正面积(以mmHg为单位);(2)收缩压和舒张压与颅内压(mmHg)的一致差异;(3) CerPP = MAP-ICP。研究发现CPR减压期胸壁回弹不完全会明显增加气管内压力,进而阻碍静脉回流,导致平均动脉压,以及冠状动脉和脑灌注压显著降低。第三步即便是恢复100%的胸廓回弹,脑灌注压只能部分恢复。该研究提示给我们的重要信息在于,高质量CPR取决于每一次的CPR而非施救者平均的CPR效果,同时也为后期的研发——CPR过程中的可视化时时监测反馈系统提供了非常重要的依据[15-16]。
2.2 CPR过程中存在多种泵机制甚至随着CPR进程发生转化随着研究深入,CPR不再是单纯的心室收缩与舒张。所以,CPR期间不再是简单的心泵与胸泵机制。一项纳入了20例非创伤性CA患者的研究显示,(1)CPR期间的血流机制随时间的变化:同一患者长时间CPR时,胸泵取代了心脏泵;(2)延长CPR时二尖瓣闭合延迟且跨二尖瓣流速(TMF)下降;(3)CA到CPR的时间越长,TMF下降越明显。(4)胸外按压时二尖瓣闭合组患者的峰值TMF、二尖瓣时速度积分、左心室每搏量和呼末二氧化碳较高[12]。研究发现CA开始时,当左心室(LV)相对柔软,按压会导致左心室和左心耳(LLRR)发生变形。由于左心室-心房压力梯度为正,二尖瓣(MV)将关闭(A)。经过长时间的CA和CPR,一个“石头般”的左心室与柔软的左心耳相连。当进行按压时,“石头般”的左心室几乎不会变形,而柔软的部分—左心耳会像往常一样变形,将血液驱入左心室,这会使二尖瓣保持开放(B)。该研究最大意义的在于发现胸泵及心泵机制随着CPR时间发生变化,长时间按压之后,胸泵取代了心泵。因此CPR快而有力的益处遭到质疑[12, 17]。甚至有学者研究发现CPR过程中存在心房泵和呼吸泵的存在[18-20]。
2.3 腹部提压心肺复苏术揭秘了腹泵机制的重大发现[21-22]“腹泵”机制是指在CPR时,利用腹腔内压力的改变,动员储存于腹部1/4的全身血液量参与人工血液循环支持。借助于腹肌的被动运动带动膈肌上下移动产生胸腔压力的改变,以完成类似于传统的经胸按压时的心泵及胸泵机制。可以作为传统经胸按压存在禁忌证时使用或与其共同使用。
3 CPR期间的通气方式、时机对机体的影响 3.1 CPR期间通气量与机体预后的关系Aufderheide等[23]曾经对比不同的通气次数(分别为12次/min、20次/min和30次/min)与CA患者的生存率、冠脉灌注压及胸腔压力的关系进行研究, 其前期观察性研究7例CA并接受气管插管的患者,同时通过气管内管和简易呼吸器之间连接无创胸内压力传感器连续记录通气情况,直到复苏尝试停止。前7例连续的病例构成第1组。在认识到救援人员在心搏骤停时持续进行高通气的患者后,研究人员立即重新培训所有急救人员,在建立安全气道后,在CPR期间以每分钟12次呼吸的速度提供通气。再进一步训练期间,不再提及每次通气的持续时间。随后的6个连续的病例(经过再培训后)构成了第2组。结合1组和2组(第3组)对数据进行分析。插管后的最大通气率为(18.8±11.9) min(范围为2~39 min)。第1组患者的平均最大通气率为3 min (37±4)次(范围19~49),通气时间为(0.85±0.07)s/呼吸,气道记录正压的时间百分比为(50±4)%。再训练后,第2组6例患者中有3例每分钟26次通气,6例患者的通气率低于第1组患者,每分钟(22±3)次呼吸(范围为15~31次)。然而,通气时间明显长于第1组患者[分别为(1.18±0.06) s/呼吸vs. (0.85±0.07) s/呼吸,P<0.05];第2组和第1组患者在气道中记录正压的时间百分比相似[分别为(44.5±8.2)% vs. (50±4)%];第3组(1组加2组)中,所有13例患者的通气率均为每分钟30次呼吸(为AHA推荐的通气率的两倍)。研究结果最初的7例全部死亡。研究第二部分在动物进行,CPR过程中连续记录主动脉压力、右房压、胸腔压力、ETCO2和脉氧饱和度。最终研究显示,与20次/min和30次/min相比,12次/min的胸腔压力明显降低、冠脉灌注压及存活率明显升高。
3.2 ROSC恢复之前,球囊送气还是机械通气辅助呼吸仍需研究进一步证实Shin等对60例OHCA患者在到达急诊后随机分成机械通气(mechanical ventilation, MV)和球囊通气(bag ventilation, BV)两组各30例。两组基线数据没有差别,结果发现ROSC恢复率分别为56.7%(MV)和43.3%(BV)(P =0.439);两组PH,PaCO2,PaO2,HCO3-及乳酸差异无统计学意义。但是MV组潮气量(P < 0.001)及分钟通气量(P =0.009)明显低于BV组[24]。很显然,BLS期间没有看到面罩一定劣于气管插管机械通气治疗,过度强调反而会因为插管不顺利导致不必要的按压间断时间过长,正如张国强等教授强调在成人BLS期间不建议常规使用被动通气技术[24-25]。
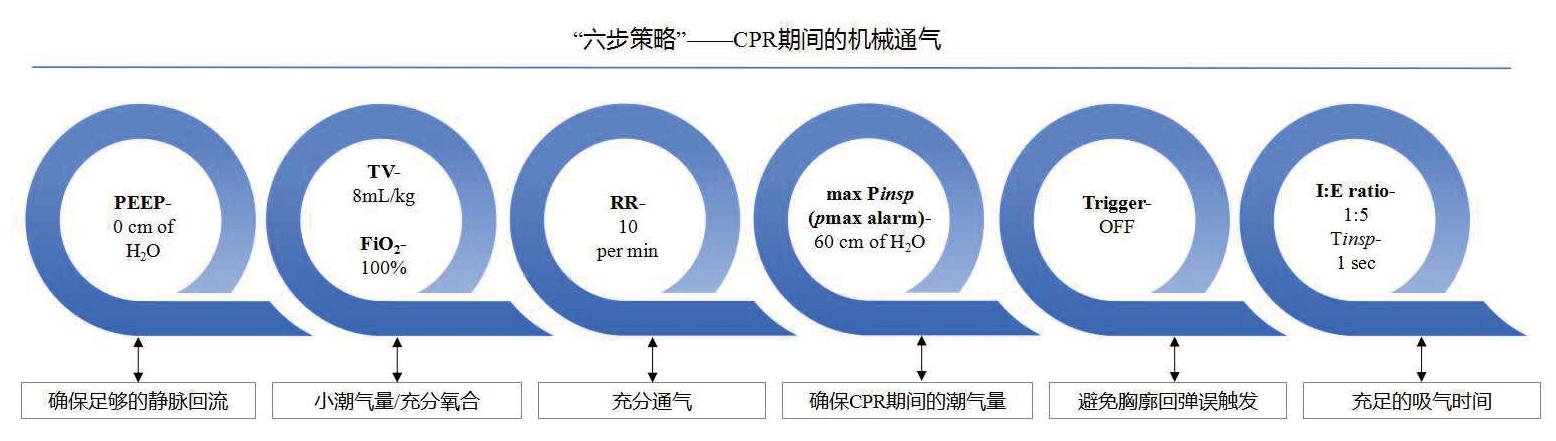
3.3 CPR期间MV送气方式对机体的影响尽管上述结果似乎MV优于球囊面罩,但是按压过程形成胸廓正压直接或间接施压于心脏模拟泵血。胸廓回弹时形成的胸腔负压与静脉回流和潮气量相关(理论上讲,此时送气潮气量最大)。考虑BLS时送气的时机是出于可能会存在按压与机械送气对冲的原因,从而会降低CPR效果以及胸廓回弹所致呼吸机误触发、高压报警等情况发生[26]。基于上述原因,有学者推荐下列“六步策略”以尽可能规避上述情况的发生(如图 2):(1)呼气末正压为0 cm H2O(允许静脉回流);(2)潮气量8 mL/kg,吸入氧气浓度100%(充分氧合);(3)呼吸频率10/min(充分通气);(4)最大吸气峰值压力或Pmax报警60 cm(允许胸部压缩期间潮气量输送);(5)关闭触发功能键(避免胸部回弹误触发);(6)吸气与呼气时间比为1:5(提供足够的吸气时间)[27]。
|
| 图 2 CPR期间的机械通气策略。PEEP,呼吸末正压;TV,潮气量;FiO2,吸入氧气浓度;Pmax alarm,最大吸气峰压报警限;I: E,吸呼比;Tmax,吸气时间。(引自医脉通) |
|
|
目前没有任何国际指南指出在MVCPR术中应用的“最佳”机械通气策略[28]。Wittig等[28]旨在总结机械CPR中应用的不同机械通气策略。基于CPR时的通气可导致吸气压力峰值升高,高吸气压力会增加肺损伤的风险,甚至影响潮气量。证据级别比较高的是需要高浓度吸氧,证据级别比较低的是关掉吸气触发并设置PEEP ≥ 5 cm H2O。现有研究在通气方式、潮气量、通气量设置和吸/呼比的理想选择方面存在许多不确定性。除了上面的考虑,按压同时机械通气在可能会降低CPR的效果,同时可能会出现肺损伤。关于CPR术中不同的通气和氧合策略如何影响血流动力学、肺损伤和CA后的结果,仍在探索中。一项临床观察研究表明,在吸气阶段,胸外按压可能会迫使空气排出肺部,导致所谓的“反向气流”,进一步使CPR期间的通气复杂化[29]。Nichol等[30]通过对23 711例患者比较连续和间断胸外按压通气的随机对照试验,引发了对通气策略的广泛关注,也引发了越来越多的认知和争论。尽管作者无法证明他们的主要结果有任何显著差异,其改良Rankin评分校正后却表明在中断按压进行通气的组中,残疾和死亡更少。该项研究的结果也促使国际复苏联络委员会(ILCOR)对CPR中连续和间断压缩进行了广泛的系统证据评估[31]。尽管ILCOR继续向专业提供者推荐这两种策略,同时也承认仍缺乏证据来指导CPR期间特定的通气策略[32-33]。对人类和动物的实验研究表明,同步正压通气对血流和胸腔内压力的影响均有报道,值得关注[34-37]。然而,在随后的临床随机试验中,与常规CPR组相比,通气同步的患者生存率较低,作者认为这可能是由于实验技术的不利影响。关于CPR期间非同步通气的观察数据显示,人类-60~-110 cm H2O的气道压力极高[38]。令人失望的临床试验结果提供了一个可能的解释。当在吸气阶段进行一到两次向下按压时,可能会发生这些高胸内压力,并可能加重CPR引起的肺损伤。Cheskes等[39]试图探讨胸部按压时同步与非同步通气对血流动力学和通气效果的影响(该研究假设是与按压-放松周期同步通气可以提供类似的血流动力学,但与非同步通气相比,肺组织损伤的风险更低)。该研究采用CA造模成功后的20头猪在给予4 min(30:2)标准的CPR后,分别尝试8 min的同步或非同步通气(10 min)。研究发现两组间血流动力学变量和吸气时间差异无统计学意义(0.4, 1.0 s,P = 0.05);相比非同步组12 min的CPR,同步通气组表现为较低的吸气峰压(57, 94 cmH2O,P < 0.001),低分钟通气(3.7, 9.4 L/min,P < 0.001),低PH(7.31, 7.53,P < 0.001),高PaCO2(39.0, 18.8 mmHg,P < 0.001)和低PaO2(237, 410 mmHg,P < 0.001),同步组和非同步组在CPR均有明显的肺损伤。Cheskes该项研究并未证实最初的假设,即非同步或符合指南的通气产生了过高的吸气峰值压力和潮气量,导致过度通气和高氧合。并得出同步和非同步通气导致相同程度的血流动力学障碍和肺损伤的结论;同时,每分钟10次的通气,在非同步通气组存在过度通气和更高的氧分压。但是也有研究长时间CPR后经常观察到的严重缺氧和高碳酸血症,源于转运过程中持续机械胸外按压和非同步手动通气的标准做法而加重[39-40]。进一步延长30 min的CPR模型的研究发现,却没有观察到两组之间动脉血液中氧气、二氧化碳和乳酸水平的任何差异。同样,该研究通过肺部CT扫描对死者的肺部情况分析,也没有观察到肺损伤的差异性[41]。一项随访研究发现,与标准机械通气相比,这种新型同步通气策略在较长时间内持续了更好的灌注,并得出结论为同步通气并没有比标准通气造成更多的肺损伤[42]。
3.4 非同步机械通气产生的反向气流与通气效果的关系持续的胸外按压有效降低了无血流时间,冠状动脉和脑灌注增加有利于改善预后,但是非同步MV产生的反向气流会不会造成潮气量减少呢?[43]现有指南建议通气时需要可见的胸部上升,持续约1 s,每分钟10次[44]。据一组全麻成人组的研究,显示平均潮气量为384 mL时出现可见的胸部上升[45]。在通气的吸气阶段,胸外按压和正压通气对胸腔施加相反的力。胸外按压产生的正压会限制通气,在某些情况下会导致气流逆转,该研究同时进行人工通气和手动胸外按压时逆转气流的人体研究发现,逆转气流的平均体积为96 mL,25例中21例患者(65%)在院前CPR期间用于量化流量,可能限制了准确性。该研究发现CPR期间平均吸气流率在23~124 L/min之间,没有发现反向气流和潮气量之间的关系[29]。两项使用机械胸外按压和机械通气的尸体研究曾报道了反向气流的发生。第一种情况是,反向气流的中位容积为71.8 mL(IQR 26.4~172),没有提供关于反向气流的通气相关比例的数据[46]。反向气流体积为0.05 mL/kg预测体重(范围0~0.7),记录的最高体积为45.6 mL,吸气时出现的中位数为1次(范围0~2)。McDannold等[47]研究显示胸外按压产生的流量通常存在局限。在CPR过程中,MV时反向气流的发生是否与净潮气量减少的争论仍在持续。Vanwulpen等[48]进行了进一步研究,旨在量化通气吸气阶段的反向气流,确定反向气流与净潮气量减少的相关性。该研究吸气阶段的开始被定义为超过20 L/min的前向气流速。呼气期的开始被定义为一个小于20 L/min的流速。反向气流被定义为在通气的吸气阶段发生的负向气流速。研究采用积分计算来确定逆气流的体积和逆气流发生前的潮气量。比较测量流量的第一分钟和最后一分钟的净潮气量、反向气流的通气比例、通气周期持续时间、吸气和呼气期持续时间。比较反向气流发生和未发生通气时的净潮气量、当前通气吸气期持续时间、前一次通气周期持续时间和前一次通气呼气期持续时间。结果显示反向气流与净潮气量无明确相关性。但是反向气流可能会通过其他方式影响通气的有效性。当气流发生逆转时,死腔通气就会增加。研究发现反向气流的体积通常很小,提示与临床相关性有限的可能原因。此外,快速变化的肺动脉压力可能会促进小气道的闭合,遗憾的是该研究未对这些病理生理过程进行评估[48]。
到目前为止,最佳的机械CPR策略仍然缺乏统一的标准。任何理论上的血流动力学益处似乎都被该策略未知的有害影响所抵消。肺损伤在所有动物中都很常见,且成为一个潜在的混杂因素。未来在CPR中的通气策略需要权衡恢复血流动力学和降低肺损伤两方面。需要补充说明的是,基于直接决定CPR是否真正成功的标志是神经系统恢复能力,而在CPR给予面罩或者机械通气治疗时更多关注PaO2,确保急性脑损伤PaO2目标值80~120 mm Hg,避免过高的PaO2等外因与高的住院病死率相关性。需要提醒注意的是,严重的低碳酸血症或高碳酸血症均与院内病死率增加相关。PaCO2的目标值35~45 mm Hg,PaCO2低导致脑血管收缩;PaCO2导致脑血管扩张;这也是脑疝或/和突发性颅内压升高时临时采用过度通气的重要原因。CPR期间脑组织灌注取决于平均动脉压与脑血管阻力即颅内压之差,而决定脑血管阻力变化的常见原因如(1)通过自动调节改变脑灌注压;(2)通过神经血管耦联改变脑代谢活动;(3)通过通气变化改变动脉血二氧化碳分压;(4)通过交感神经支配脑阻力血管改变交感神经活动(不同的机制可能会影响脑阻力血管的不同区段。例如,交感神经刺激会收缩大的脑动脉,而血压升高则会收缩小脑动脉)。所以,需要考虑到CA患者不同状态下的PaCO2目标值,防止出现机械通气设置不当导致的进一步脑损伤。
蛮有意思的是,CPR期间的通气至今为止仍然具有对指南的挑战,甚至还在继续。Prause等[49]在CA患者中通气频率进行研究,比较了OHCA在CPR期间每分钟10次呼吸和20次呼吸对预后的影响(两组均为潮气量6 mL/kg,100%氧气吸入)。该研究的受试者中50%实现了自发性循环(ROSC)的恢复,远超过了OHCA时小于平均ROSC恢复率(30%)。因此,尽管该研究采用了复苏指南推荐的通气频率增加了一倍且表现出明显的气体交换异常,但却出现了高ROSC恢复率。Gazmuri等[50]曾汇总了多篇高质量的研究,试图呼吁实践与指南之间存在的科学差距,倡导继续寻找CPR状态下理想的通气策略。通过研究揭示和刺激关于CPR中当前通气和气体交换方法的许多挥之不去的科学差距的讨论,以及创造强有力的研究措施来弥补这些差距。
4 CPR相关的损伤CPR过程中,肋骨骨折的发生了26.8%~70%,胸骨骨折4.2%~30%,且老年CA患者每增加一处肋骨骨折,病死率增加19%、肺炎风险增加27%[51]。CPR相关的损伤包括缺血-再灌注及机械损伤两个方面:表现为肺挫伤、ROSC后ARDS、继发感染。在复苏过程中使用的力度以及复苏的持续时间,增加了对患者损伤的风险[52]。当执行低质量的CPR术时,这些伤害的风险还会增加[53]。汇总CPR相关的肺损伤主要源于以下几个方面的原因:如胸外心脏按压所致压力性肺损伤、正压通气相关肺损伤、高浓度氧疗所致的肺损伤、缺血-再灌注介导的免疫调节失衡、基础疾病及并发症、胸廓骨性结构损伤等。一项来自CA患者的尸解研究发现[54],与手工CPR相比,机械CPR更容易导致肺损伤(4% vs. 18.6%)。经过CT显示的CPR后患者胸部损伤情况发现[55],43例非创伤性CA患者,CPR后成功复苏,并在CPR后24 h内进行了胸部CT扫描计算损伤情况。显示出肺挫伤(平均LCS: 22,范围: 5~47),肺挫伤分布为在双侧肺依赖部位(41例)。43例中CPR 48 h后发生ARDS 8例(18.6%),没有发生ARDS 24例(55.8%),未知11例(25.6%)。发生双侧肺挫伤表现为实变1例、毛玻璃影2例、两者都有40例。肋骨骨折都发生在前弓(43例),胸骨骨折主要发生在胸骨中段(31例);CPR的持续时间与肋骨骨折的数量明确相关,但与胸骨骨折及相关肺挫伤或其他CPR相关胸部损伤的程度无明确关系。年龄小于70岁的患者相比之下,接受CPR超过25 min的患者肋骨骨折的数量明显超过接受CPR少于25 min的患者(中位数4.5 vs. 9;人均8.3 vs. 5.6; P = 1.03)。接受CPR超过10 min的胸骨骨折发生率高于接受CPR的患者少于10 min(OR: 3.60; 95%CI: 0.86~15.06; P=0.079)。研究的进一步深入发现复苏相关的肺水肿得到了广泛的重视[56]。CA后机械通气参数设置不当、人工气道或呼吸机应用不当,导致气道阻力过大、通气动力不足或人机配合不协调、ROSC之后患者出现呼吸肌本体感受器兴奋、呼吸肌收缩力增强,呼吸加深等增加胸腔负压及肺间质负压导致负压性肺水肿。也有的学者认为CPR相关的肺水肿属于为恢复心搏而付出的代价[57]。ROSC之后高浓度氧疗可以导致急性肺损伤,并于心脏骤停患者的病死率增加和不良神经功能预后相关[58-59]。更重要的是高浓度氧疗未改善ECMO患者神经系统的预后[60]。推测与高氧诱导以中性粒细胞、细胞因子和趋化因子水平升高为特征的时间和浓度依赖性肺损伤[61],以及高浓度氧与ECPR期间病死率增加有关,其机制推测与通过促进循环衰竭或延迟性神经损伤有关[62]。
5 其他 5.1 存在可除颤心律的CA需要适当延长CPR时间来自日本的一项回顾性研究显示,CA患者能否在恢复ROSC之后保留理想的神经系统功能,关键在于最初数分钟内的高质量的CPR。尤其是对于存在可除颤心律的9 min内和非可除颤心律的6 min内ROSC效果最好,对于存在可除颤心律的4 min内和非可除颤心律的3 min内出现ROSC与良好的神经功能有非常强的相关性[63]。
5.2 机械CPR与手动CPR孰优孰劣?手动CPR存在容易疲劳、受施救者位置的限制及难以持续高质量CPR等不利因素;机械CPR具有不存在疲劳感、持续精准、用于危险环境等优势。但是,现有研究均为非劣效性研究,且都是在手动CPR至少15 min之后采用的机械CPR的相关研究,更重要的是机械CPR均没有被现有指南推荐为常规使用(尤其是IHCA)。两者的共性,均会发生骨折、气胸、内脏损伤的风险。即便在任何条件下使用机械CPR,其前提条件是临床医师必须确保在最短时间内安装设备以减少按压中断及在场能够确保随时观察到患者病情变化。Kahn等[64]观察2010—2016年,美国院前急救医疗服务专业人员对OHCA患者使用机械CPR设备的频率,该项横断面研究中,在所有OHCA患者中,经风险调整后使用机械CPR装置的比例从1.9%上升到8.0%(4倍以上)。当按人口特征和地理位置进行分层时,这种增长在患者中是一致的。鉴于机械CPR装置的高成本及手动CPR的可及性,需要更好的证据来确定这些装置在改善院前EMS专业人员治疗OHCA患者合理性[64-65]。
5.3 CPR应定期培训而非一劳永逸一项纳入461人的问卷调查,旨在探讨不同医务人员及后勤人员对CPR的知晓率,问卷涉及BLS 15分、ALS 5分,总分20分。141人(30.6%) 为执业医师、268人(58.1%)护理人员及52人(11.3%)后勤人员纳入研究。结果发现,所有医护人员的得分为(8.9±4.7)分。内科医生、护士和后勤人员的平均得分分别为(8.6±3.4)分、(9±3.6)分和(9±3.3)分。研究显示普遍认知不足并且尤为突出的是医生,对BLS/ACLS原则存在诸多的空白且建议继续修订培训系统[66]。南非一所州立大学的注册研究(横断面研究)旨在探讨两位成人施救者CPR的准确性。在142名登记注册人中选取47人参与了分析,其中44人被纳入了分析。在5个周期的CPR术中,分别评估了在人体模型上的按压质量和气道管理。每组有一名最近接受过BLS训练的学生研究员作为第二救援者。结果显示:总百分比得分中位数为82.2%(范围为33.3%~100.0%)。88.6%的注册医师按压位置准确,25.0%按压频率正确,93.2%按压深度正确,61.4%的注册医师在按压后达到完全的胸部回弹。E-C手法准确率77.3%、正确的通气率占93.2%、63.6%的患者处于正确的气道开放,61.4%的患者实现了明显的胸部起伏、59.1%的注册医师进行了持续正确的按压-通气比[67]。更重要的是,研究显示高质量CPR的下滑在上一次接受CPR培训3年后尤为明显,该研究提示应该强制性、定期CPR培训。来自厄瓜多尔,旨在了解医生对于基本生命支持(BLS)和高级生命支持(ALS)的理论知识状况的研究, 该项研究为2023年2~3月期间,进行了一项全国横断面35个问题在线调查,使用了自我管理的、专家验证的问卷。参与者的回复是通过官方社交媒体组(WhatsApp和Facebook)获得的。该调查评估了BLS和ALS的理论知识,根据正确答案的数量得分,最高为10.0分。该调查获得了385名医生的回复,其中大多数为女性(56.6%),工作经验少于3年(75.1%)。其中,分别有71.7%和51.9%持有BLS和ALS认证。BLS的知识得分(5.8/10 ± 1.6)分超过了ALS的知识得分(4.7/10 ± 1.8)分(P < 0.001)。工作经验少于3年的医生在BLS和ALS测试中均表现出较高的知识分数(P < 0.05)。本研究显示,被调查的厄瓜多尔医生对BLS和ALS的理论知识明显不足。已获得认证具有多年工作经验人员未必占优势,更证实CPR持续培训和更新是提升医生技能和改善患者预后的关键[68]。
5.4 CPR相关的重要参数理解CPR指南背后的原因及不同CA患者的不同病理生理状态,所谓知其然还需知其所以然,只有这样才是避免出现低级错误、真正提高CPR质量重要的前提[69]。
5.4.1 目标按压质量按压质量取决于按压的速度和深度同时达到AHA指南。过快的按压容易导致操作者疲劳且没有足够的时间确保心脏充盈;相反,按压过慢则无法维持心输出量。深度过浅不能产生血流、过深会导致CPR相关损伤。强调确保CA患者真正存活下来的是每一次按压产生的血流,而非一分钟内的平均速度或者深度。
5.4.2 胸外按压释放速率(chest compression release velocity, CCRV)胸部回弹不完全会降低心输出量和心肌本身的血流。研究显示>400 mm/s时可以改善出院时生存率和良好的神经功能(每增加10 mm/s会增加5.2%)[70]。CCRV在装有弹簧的模拟人身上并不能准确体现,而在CA患者中获取的数据是准确的。
5.4.3 CPR分数CPR分数是指在整个模拟过程中,施救者进行CPR的所有时间总和。CPR过程中经常发生的中断场景,如节律分析、检查脉搏、通气或者交换按压者等都会对血流产生负面影响。
5.4.4 除颤前暂停定义为CPR停止到给予电击之间的时间,节律分析经常会导致按压中断。对于可除颤心律时首选电除颤,但是强调在电击之前(包括充电中)尽可能维持按压状态。
5.4.5 电击后暂停电击后暂停定义为给予除颤之后和恢复按压之间的时间。在给予一次除颤之后按压应该立即恢复,不能因为检查脉搏或者更换按压者延误按压。
5.4.6 团队意识充分利用在场的所有施救者,保证2 min交换按压者。按压过程中的按压者的站位、每个人的职责、设备摆放的位置、复苏流程、除颤过程等均需要标准化。如果可能,从实际的CPR提取客观的CPR相关质量的数据用以持续质量改进。
利益冲突 所有作者声明无利益冲突
| [1] | Merchant RM, Berg RA, Yang L, et al. Hospital variation in survival after in-hospital cardiac arrest[J]. J Am Heart Assoc, 2014, 3(1): e000400. DOI:10.1161/jaha.113.000400 |
| [2] | 李春盛. 目前心肺复苏存在的问题及对策[J]. 中华急诊医学杂志, 2005, 14(5): 362-363. DOI:10.3760/j.issn:1671-0282.2005.05.002 |
| [3] | 李春盛. 心肺复苏的研究进展[J]. 中华急诊医学杂志, 2011, 20(1): 11-13. DOI:10.3760/cma.j.issn.1671-0282.2011.01.004 |
| [4] | 王立祥, 沈洪. 个体化心肺复苏[J]. 中华急诊医学杂志, 2007, 16(8): 895-896. DOI:10.3760/j.issn:1671-0282.2007.08.035 |
| [5] | 王立祥. 心肺复苏共识的再认识[J]. 中华急诊医学杂志, 2010, 19(1): 108-110. DOI:10.3760/cma.j.issn.1671-0282.2010.01.032 |
| [6] | 王立祥, 黄子通. 心肺复苏的误区探讨[J]. 临床误诊误治, 2013, 26(1): 1-4. DOI:10.3969/j.issn.1002-3429.2013.01.001 |
| [7] | Virani SS, Alonso A, Aparicio HJ, et al. Heart disease and stroke statistics-2021 update: a report from the American heart association[J]. Circulation, 2021, 143(8): e254-e743. DOI:10.1161/CIR.0000000000000950 |
| [8] | 中国心脏骤停与心肺复苏报告编写组. 中国心脏骤停与心肺复苏报告(2022年版)概要[J]. 中国循环杂志, 2023, 38(10): 1005-1017. DOI:10.3969/j.issn.1000-3614.2023.10.002 |
| [9] | Shao F, Li CS, Liang LR, et al. Incidence and outcome of adult in-hospital cardiac arrest in Beijing, China[J]. Resuscitation, 2016, 102: 51-56. DOI:10.1016/j.resuscitation.2016.02.002 |
| [10] | Shao F, Li HB, Ma SK, et al. Outcomes of out-of-hospital cardiac arrest in Beijing: a 5-year cross-sectional study[J]. BMJ Open, 2021, 11(4): e041917. DOI:10.1136/bmjopen-2020-041917 |
| [11] | Banerjee P, Ganti L, Stead TG, et al. Every one-minute delay in EMS on-scene resuscitation after out-of-hospital pediatric cardiac arrest lowers ROSC by 5[J]. Resusc Plus, 2021, 5: 100062. DOI:10.1016/j.resplu.2020.100062 |
| [12] | Liu YC, Tian Z, Yu CH, et al. Transesophageal echocardiography to assess mitral valve movement and flow during long term cardiopulmonary resuscitation: how cardiac effects fade with time[J]. Int J Cardiol, 2016, 223: 693-698. DOI:10.1016/j.ijcard.2016.08.274 |
| [13] | Kim H, Hwang SO, Lee CC, et al. Direction of blood flow from the left ventricle during cardiopulmonary resuscitation in humans: its implications for mechanism of blood flow[J]. Am Heart J, 2008, 156(6): 1222.e1-1222.e7. DOI:10.1016/j.ahj.2008.09.003 |
| [14] | Yannopoulos D, McKnite S, Aufderheide TP, et al. Effects of incomplete chest wall decompression during cardiopulmonary resuscitation on coronary and cerebral perfusion pressures in a porcine model of cardiac arrest[J]. Resuscitation, 2005, 64(3): 363-372. DOI:10.1016/j.resuscitation.2004.10.009 |
| [15] | Lee H, Kim J, Joo S, et al. The effect of audiovisual feedback of monitor/defibrillators on percentage of appropriate compression depth and rate during cardiopulmonary resuscitation[J]. BMC Anesthesiol, 2023, 23(1): 334. DOI:10.1186/s12871-023-02304-9 |
| [16] | Jiang JH, Yan JH, Yao DA, et al. Comparison of the effects of using feedback devices for training or simulated cardiopulmonary arrest[J]. J Cardiothorac Surg, 2024, 19(1): 159. DOI:10.1186/s13019-024-02669-z |
| [17] | Harris AW, Kudenchuk PJ. Cardiopulmonary resuscitation: the science behind the hands[J]. Heart, 2018, 104(13): 1056-1061. DOI:10.1136/heartjnl-2017-312696 |
| [18] | Ma MH, Hwang JJ, Lai LP, et al. Transesophageal echocardiographic assessment of mitral valve position and pulmonary venous flow during cardiopulmonary resuscitation in humans[J]. Circulation, 1995, 92(4): 854-861. DOI:10.1161/01.cir.92.4.854 |
| [19] | Convertino VA, Ryan KL, Rickards CA, et al. Optimizing the respiratory pump: harnessing inspiratory resistance to treat systemic hypotension[J]. Respir Care, 2011, 56(6): 846-857. DOI:10.4187/respcare.01018 |
| [20] | Cipani S, Bartolozzi C, Ballo P, et al. Blood flow maintenance by cardiac massage during cardiopulmonary resuscitation: classical theories, newer hypotheses, and clinical utility of mechanical devices[J]. J Intensive Care Soc, 2019, 20(1): 2-10. DOI:10.1177/1751143718778486 |
| [21] | 中国腹部提压心肺复苏协作组. 腹部提压心肺复苏专家共识[J]. 中华急诊医学杂志, 2013, 22(9): 957-959. DOI:10.3760/cma.j.issn.1671-0282.2013.09.004 |
| [22] | 王立祥, 宋维, 张思森, 等. 腹部提压心肺复苏多中心临床试验报告[J]. 中华急诊医学杂志, 2017, 26(3): 333-336. DOI:10.3760/cma.j.issn.1671-0282.2017.03.019 |
| [23] | Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation[J]. Circulation, 2004, 109(16): 1960-1965. DOI:10.1161/01.CIR.0000126594.79136.61 |
| [24] | Shin J, Lee HJ, Jin KN, et al. Automatic mechanical ventilation vsManual bag ventilation during CPR[J]. Chest, 2024, 166(2): 311-320. DOI:10.1016/j.chest.2024.02.020 |
| [25] | 张国强. 心脏骤停及心肺复苏技术的现状、挑战与机遇[J]. 中华急诊医学杂志, 2023, 32(1): 1-5. DOI:10.3760/cma.j.issn.1671-0282.2023.01.001 |
| [26] | Senthilnathan M, Ravi R, Suganya S, et al. Manual vs. mechanical ventilation in patients with advanced airway during CPR[J]. Indian Heart J, 2022, 74(5): 428-429. DOI:10.1016/j.ihj.2022.07.007 |
| [27] | Sahu AK, Timilsina G, Mathew R, et al. "Six-dial strategy" -mechanical ventilation during cardiopulmonary resuscitation[J]. Indian J Crit Care Med, 2020, 24(6): 487-489. DOI:10.5005/jp-journals-10071-23464 |
| [28] | Wittig J, Orlob S, Prause G. Ventilation during cardiac arrest and after return of spontaneous circulation: like father, like son?[J]. Respir Care, 2021, 66(3): 538-539. DOI:10.4187/respcare.08791 |
| [29] | Duchatelet C, Kalmar AF, Monsieurs KG, et al. Chest compressions during ventilation in out-of-hospital cardiac arrest cause reversed airflow[J]. Resuscitation, 2018, 129: 97-102. DOI:10.1016/j.resuscitation.2018.03.035 |
| [30] | Nichol G, Leroux B, Wang H, et al. Trial of continuous or interrupted chest compressions during CPR[J]. N Engl J Med, 2015, 373(23): 2203-2214. DOI:10.1056/NEJMoa1509139 |
| [31] | Ashoor HM, Lillie E, Zarin W, et al. Effectiveness of different compression-to-ventilation methods for cardiopulmonary resuscitation: a systematic review[J]. Resuscitation, 2017, 118: 112-125. DOI:10.1016/j.resuscitation.2017.05.032 |
| [32] | Olasveengen TM, Mancini ME, Perkins GD, et al. Adult Basic Life Support[J]. Resuscitation, 2020, 156: A35-A79. DOI:10.1016/j.resuscitation.2020.09.010 |
| [33] | Soar J, Berg KM, Andersen LW, et al. Adult advanced life support: 2020 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations[J]. Resuscitation, 2020, 156: A80-A119. DOI:10.1016/j.resuscitation.2020.09.012 |
| [34] | Chandra N, Rudikoff M, Weisfeldt ML. Simultaneous chest compression and ventilation at high airway pressure during cardiopulmonary resuscitation[J]. Lancet, 1980, 1(8161): 175-178. DOI:10.1016/s0140-6736(80)90662-5 |
| [35] | Chandra N, Weisfeldt ML, Tsitlik J, et al. Augmentation of carotid flow during cardiopulmonary resuscitation by ventilation at high airway pressure simultaneous with chest compression[J]. Am J Cardiol, 1981, 48(6): 1053-1063. DOI:10.1016/0002-9149(81)90320-9 |
| [36] | Koehler RC, Chandra N, Guerci AD, et al. Augmentation of cerebral perfusion by simultaneous chest compression and lung inflation with abdominal binding after cardiac arrest in dogs[J]. Circulation, 1983, 67(2): 266-275. DOI:10.1161/01.cir.67.2.266 |
| [37] | Swenson RD, Weaver WD, Niskanen RA, et al. Hemodynamics in humans during conventional and experimental methods of cardiopulmonary resuscitation[J]. Circulation, 1988, 78(3): 630-639. DOI:10.1161/01.cir.78.3.630 |
| [38] | Olasveengen TM, Skåre C, Skjerven-Martinsen M, et al. Lung tissue injury and hemodynamic effects of ventilations synchronized or unsynchronized to continuous chest compressions in a porcine cardiac arrest model[J]. Resusc Plus, 2024, 17: 100530. DOI:10.1016/j.resplu.2023.100530 |
| [39] | Cheskes S, Schmicker RH, Richard-Verbeek P, et al. Lung tissue injury and hemodynamic effects of ventilations synchronized or unsynchronized to continuous chest compressions in a porcine cardiac arrest model[J]. Resuscitation, 2014, 85(3): 336-342. DOI:10.1016/j.resuscitation.2013.10.014 |
| [40] | Spindelboeck W, Gemes G, Strasser C, et al. Arterial blood gases during and their dynamic changes after cardiopulmonary resuscitation: a prospective clinical study[J]. Resuscitation, 2016, 106: 24-29. DOI:10.1016/j.resuscitation.2016.06.013 |
| [41] | Kopra J, Litonius E, Pekkarinen PT, et al. Ventilation during continuous compressions or at 30: 2 compression-to-ventilation ratio results in similar arterial oxygen and carbon dioxide levels in an experimental model of prolonged cardiac arrest[J]. Intensive Care Med Exp, 2023, 11(1): 3. DOI:10.1186/s40635-022-00485-0 |
| [42] | Kill C, Galbas M, Neuhaus C, et al. Chest compression synchronized ventilation versus intermitted positive pressure ventilation during cardiopulmonary resuscitation in a pig model[J]. PLoS One, 2015, 10(5): e0127759. DOI:10.1371/journal.pone.0127759 |
| [43] | Orlob S, Wittig J, Hobisch C, et al. Reliability of mechanical ventilation during continuous chest compressions: a crossover study of transport ventilators in a human cadaver model of CPR[J]. Scand J Trauma Resusc Emerg Med, 2021, 29(1): 102. DOI:10.1186/s13049-021-00921-2 |
| [44] | Newell C, Grier S, Soar J. Airway and ventilation management during cardiopulmonary resuscitation and after successful resuscitation[J]. Crit Care, 2018, 22(1): 190. DOI:10.1186/s13054-018-2121-y |
| [45] | Baskett P, Nolan J, Parr M. Tidal volumes which are perceived to be adequate for resuscitation[J]. Resuscitation, 1996, 31(3): 231-234. DOI:10.1016/0300-9572(96)00994-x |
| [46] | Segond N, Terzi N, Duhem H, et al. Mechanical ventilation during cardiopulmonary resuscitation: influence of positive end-expiratory pressure and head-torso elevation[J]. Resuscitation, 2023, 185: 109685. DOI:10.1016/j.resuscitation.2022.109685 |
| [47] | McDannold R, Bobrow BJ, Chikani V, et al. Quantification of ventilation volumes produced by compressions during emergency department cardiopulmonary resuscitation[J]. Am J Emerg Med, 2018, 36(9): 1640-1644. DOI:10.1016/j.ajem.2018.06.057 |
| [48] | Vanwulpen M, Cornelis R, Bouillon A, et al. Is the occurrence of reversed airflow in manual ventilation during cardiopulmonary resuscitation associated with reduced net tidal volumes?[J]. Resusc Plus, 2024, 17: 100557. DOI:10.1016/j.resplu.2024.100557 |
| [49] | Prause G, Zoidl P, Eichinger M, et al. Mechanical ventilation with ten versus twenty breaths per minute during cardio-pulmonary resuscitation for out-of-hospital cardiac arrest: a randomised controlled trial[J]. Resuscitation, 2023, 187: 109765. DOI:10.1016/j.resuscitation.2023.109765 |
| [50] | Gazmuri RJ, Ayoub I. Ventilation during CPR: a challenge to guidelines and a call for research on lingering scientific gaps[J]. Resuscitation, 2023, 187: 109811. DOI:10.1016/j.resuscitation.2023.109811 |
| [51] | Dunham GM, Perez-Girbes A, Bolster F, et al. Use of whole body CT to detect patterns of CPR-related injuries after sudden cardiac arrest[J]. Eur Radiol, 2018, 28(10): 4122-4127. DOI:10.1007/s00330-017-5117-0 |
| [52] | Buschmann CT, Tsokos M. Frequent and rare complications of resuscitation attempts[J]. Intensive Care Med, 2009, 35(3): 397-404. DOI:10.1007/s00134-008-1255-9 |
| [53] | National Health Act 61 of 2003[EB/OL]. https://www.gov.za/documents/national-health-act. |
| [54] | Ondruschka B, Baier C, Bayer R, et al. Chest compression-associated injuries in cardiac arrest patients treated with manual chest compressions versus automated chest compression devices (LUCAS Ⅱ) - a forensic autopsy-based comparison[J]. Forensic Sci Med Pathol, 2018, 14(4): 515-525. DOI:10.1007/s12024-018-0024-5 |
| [55] | Jang SJ, Cha YK, Kim JS, et al. Computed tomographic findings of chest injuries following cardiopulmonary resuscitation: more complications for prolonged chest compressions?[J]. Medicine (Baltimore), 2020, 99(33): e21685. DOI:10.1097/MD.0000000000021685 |
| [56] | Marchese G, Bungaro E, Magliocca A, et al. Acute lung injury after cardiopulmonary resuscitation: a narrative review[J]. J Clin Med, 2024, 13(9): 2498. DOI:10.3390/jcm13092498 |
| [57] | Geri G, Richard JC. Cardiopulmonary resuscitation-associated lung edema: the price to pay to get the heartbeat?[J]. Am J Respir Crit Care Med, 2021, 203(4): 405-406. DOI:10.1164/rccm.202009-3445ED |
| [58] | Elmer J, Scutella M, Pullalarevu R, et al. The association between hyperoxia and patient outcomes after cardiac arrest: analysis of a high-resolution database[J]. Intensive Care Med, 2015, 41(1): 49-57. DOI:10.1007/s00134-014-3555-6 |
| [59] | Roberts BW, Kilgannon JH, Hunter BR, et al. Association between early hyperoxia exposure after resuscitation from cardiac arrest and neurological disability: prospective multicenter protocol-directed cohort study[J]. Circulation, 2018, 137(20): 2114-2124. DOI:10.1161/CIRCULATIONAHA.117.032054 |
| [60] | Kashiura M, Yasuda H, Kishihara Y, et al. Association between short-term neurological outcomes and extreme hyperoxia in patients with out-of-hospital cardiac arrest who underwent extracorporeal cardiopulmonary resuscitation: a retrospective observational study from a multicenter registry[J]. BMC Cardiovasc Disord, 2022, 22(1): 163. DOI:10.1186/s12872-022-02598-6 |
| [61] | Helmerhorst HJF, Schouten LRA, Wagenaar GTM, et al. Hyperoxia provokes a time- and dose-dependent inflammatory response in mechanically ventilated mice, irrespective of tidal volumes[J]. Intensive Care Med Exp, 2017, 5(1): 27. DOI:10.1186/s40635-017-0142-5 |
| [62] | Bonnemain J, Rusca M, Ltaief Z, et al. Hyperoxia during extracorporeal cardiopulmonary resuscitation for refractory cardiac arrest is associated with severe circulatory failure and increased mortality[J]. BMC Cardiovasc Disord, 2021, 21(1): 542. DOI:10.1186/s12872-021-02361-3 |
| [63] | Takei Y, Toyama G, Takahashi T, et al. Optimal duration and timing of basic-life-support-only intervention for patients with out-of-hospital cardiac arrest[J]. Sci Rep, 2024, 14(1): 6071. DOI:10.1038/s41598-024-56487-3 |
| [64] | Kahn PA, Dhruva SS, Rhee TG, et al. Use of mechanical cardiopulmonary resuscitation devices for out-of-hospital cardiac arrest, 2010-2016[J]. JAMA Netw Open, 2019, 2(10): e1913298. DOI:10.1001/jamanetworkopen.2019.13298 |
| [65] | Mitchell OJL, Shi XY, Abella BS, et al. Mechanical cardiopulmonary resuscitation during in-hospital cardiac arrest[J]. J Am Heart Assoc, 2023, 12(7): e027726. DOI:10.1161/JAHA.122.027726 |
| [66] | Nambiar M, Nedungalaparambil NM, Aslesh OP. Is current training in basic and advanced cardiac life support (BLS & ACLS) effective? A study of BLS & ACLS knowledge amongst healthcare professionals of North-Kerala[J]. World J Emerg Med, 2016, 7(4): 263-269. DOI:10.5847/wjem.j.1920-8642.2016.04.004 |
| [67] | Hartslief B, Janse van Rensburg C, Maartens A, et al. Accuracy of two-rescuer adult CPR performed by medical registrars at a South African university[J]. Afr J Emerg Med, 2023, 13(3): 199-203. DOI:10.1016/j.afjem.2023.06.006 |
| [68] | Izquierdo-Condoy JS, Naranjo-Lara P, Arias Rodríguez FD, et al. Assessing the proficiency in basic and advanced life support among physicians in Ecuador: a cross-sectional study[J]. Adv Med Educ Pract, 2024, 15: 25-35. DOI:10.2147/AMEP.S440437 |
| [69] | Panchal AR, Bartos JA, Cabañas JG, et al. Part 3: adult basic and advanced life support: 2020 American heart association guidelines for cardiopulmonary resuscitation and emergency cardiovascular care[J]. Circulation, 2020, 142(16_suppl_2): S366-S468. DOI:10.1161/CIR.0000000000000916 |
| [70] | Kovacs A, Vadeboncoeur TF, Stolz U, et al. Chest compression release velocity: Association with survival and favorable neurologic outcome after out-of-hospital cardiac arrest[J]. Resuscitation, 2015, 92: 107-114. DOI:10.1016/j.resuscitation.2015.04.026 |
 2025, Vol. 34
2025, Vol. 34