2. 扬州洪泉医院内分泌科,扬州 225200;
3. 南京医科大学第一附属医院,南京 210000
艾迪森危象(addisonian crisis, AC),也称为肾上腺危象或急性肾上腺皮质功能减退症,是由于皮质醇激素分泌严重不足而发生的一组威胁生命的症候群,最常发生在肾上腺皮质功能减退症(adrenal insufficiency,AI)的患者中,且死亡率高[1]。有文献报道,AI发病率在欧洲为93~144例/百万人[2],AC的发生率为(5~12)例/百万人,死亡率为0.05%[1],由于AC是一种罕见病,临床表现缺乏特异性,易发生漏诊及误诊,本文报道我科收治无明显诱因原发性肾上腺危象,伴低血压休克患者,常规补液和去甲肾上腺素治疗循环无改善1例(已取得患者知情同意)。结合相关文献复习,以期提高基层急诊医师对AC的认识。
1 资料与方法患者女性,58岁,因“反复恶心1月余加重伴头晕胸闷一天”于2024-03-02入院。1月前患者开始出现反复恶心,并伴有食欲减退,恶心呕吐症状逐渐加重,期间在当地卫生院就诊,服用抑酸护胃类药物,症状未见明显改善。2024-03-02 19:00左右患者感头晕、胸闷不适,肢体乏力症状较前明显加重,家属遂送至本院急诊。查体BP: 90/40 mmHg (1 mmHg=0.133 kPa)、HR: 108次/min、R: 18次/min、昏睡状态,呼之能应,肤色黝黑。急诊血气分析pH: 7.37、PCO2: 32.8 mmHg、PO2: 277 mmHg(FiO2 41%)、血电解质Na+ 125 mmol/L、K+: 4.4 mmol/L HCO3-: 18.8 mmol/L, BE -5.4 mmol/L, Lac: 1.4 mmol/L, Hb: 15.4 g/dL、血糖6.2 mmol/L。头胸及全腹部CT显示: 双侧基底节腔隙梗塞,两肺纹理增多、两上肺钙化灶,双侧肾上腺占位伴钙化、胆囊结石、左肾小结石,(见图 1)。心电图: ①窦性心动过速;②异常Q波(Ⅱ、Ⅲ、aⅤF);③ST-T改变(Ⅱ、Ⅲ、aⅤF、Ⅴ4、Ⅴ5、Ⅴ6);④ 肢导联低电压。急诊予以鼻塞吸氧、补液、升压、护胃止吐、纠正电解质紊乱等对症治疗,考虑患者病情危重,以“休克”收入本院EICU。入院后追问患者家人,患者近2年来逐渐出现乏力,全身皮肤逐渐变黑,由头面部开始,逐渐过渡至手足各关节,胃纳差,消瘦,未予重视,体重下降14 kg。
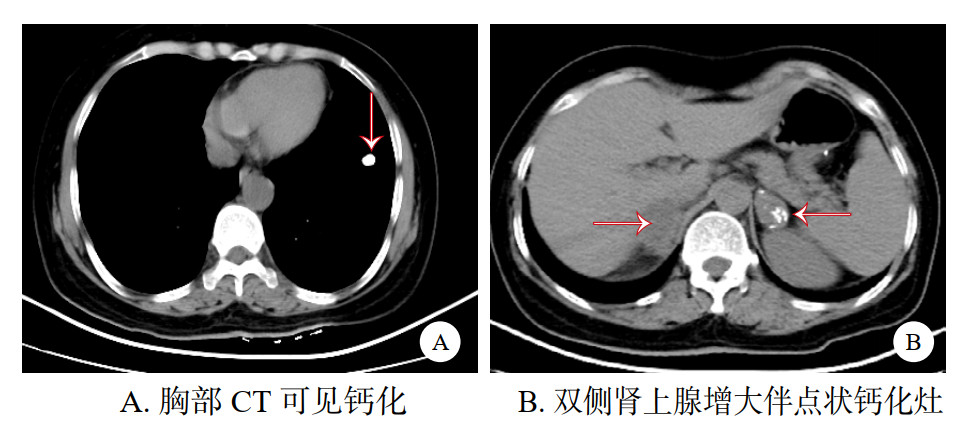
|
| 图 1 胸腹部CT |
|
|
既往史:有子宫肌瘤未手术治疗,否认高血压、冠心病、糖尿病等慢性病史,否认肝炎结核等传染病史,无手术史,无输血史。已婚,育有一子,体健,家族无遗传病史。
入EICU后体格检查,体温:38.1 ℃,脉搏:103次/min,呼吸:19次/min,血压:88/71 mmHg。GCS 10分,全身皮肤干燥黝黑,可见色素沉着,脸颊、口唇和舌黏膜片状色素沉着(见图 3、4),指甲有纵向条带状色素沉着(图 5)。双肺听诊未闻及干湿性啰音,心率103次/min,律齐,心音低、各瓣膜未闻杂音,腹软,无压痛,肾区无叩痛,双下肢无水肿。初步诊断:脓毒性休克?胃肠炎?尿路感染?低钠血症,肾上腺占位,胆囊结石、肾结石。入科后辅助检查PCT < 0.1 ng/mL;血常规:WBC: 3.99×109/L,Hb: 101 g/L,Plt 167×109/L,中性粒细胞比值61%,淋巴细胞绝对计数1.2×109/L,红细胞分布宽度CV值11.3%;血K+ 4.3 mmol/L、Na+ 128.9 mmol/L,尿常规:白细胞(-),酮体(1+),隐血(1+);白蛋白34.07 g/L,肝肾功能、肌钙蛋白、甲状腺功能、糖化血红蛋白未见异常。
医嘱给予哌拉西林他唑巴坦抗感染,补液扩容、补充血钠,去甲肾上腺素2.7 μg/(kg·min)持续泵入,期间血压波动在78~100/51~69 mmHg之间。患者血压对去甲肾上腺素呈明显依赖,在补充1 000 mL胶体及1 700 mL晶体后,去甲肾上腺素一旦减量血压即降低到上述下界值。经补液后患者尿量维持250 mL/h。床旁超声可见下降静脉宽度由入院时的1.0 cm增加至1.9 cm。由于CT提示肾上腺占位,遂请内分泌科会诊, 考虑肾上腺占位伴肾上腺危象可能,遂完善腹部增强CT可见双侧肾上腺增大,不规则,伴少量钙化(图 2)。03-03晨8:00测血皮质醇14.96 ng/mL (52.7~224.5 ng/mL)、促肾上腺皮质激素1 096 ng/mL (≤ 46 ng/mL),加用氢化可的松200 mg快速静滴,随后200 mg静脉泵入维持24 h,2024-03-03日下午患者神志清楚,精神状态改善,恢复自主进食,血压逐渐上升并维持在130~140/60~85 mmHg,血钠130 mmol/L。03-04日,患者神志清楚,GCS评分15分,去甲肾上腺素减停,血压波动在125~130/58~86 mmHg左右,继续予以氢化可的松200 mg静脉泵入维持,当日下午转入内分泌病房继续治疗。住院期间氢化可的松用量情况见(图 6),03-09日停用氢化可的松后改为醋酸泼尼松片口服,日剂量为8:00 5 mg,16:00 2.5 mg。期间查T-spot阳性,抗核抗体谱、自身免疫性抗体、病毒学均阴性。出院诊断: 原发性肾上腺皮质功能不全,肾上腺危象。症状好转后于2024-03-13日出院,出院继续维持醋酸泼尼松片8:00 5 mg,口服,16:00 2.5 mg,口服用药方案。随访至今,患者一般情况良好,可从事简单体力劳动。
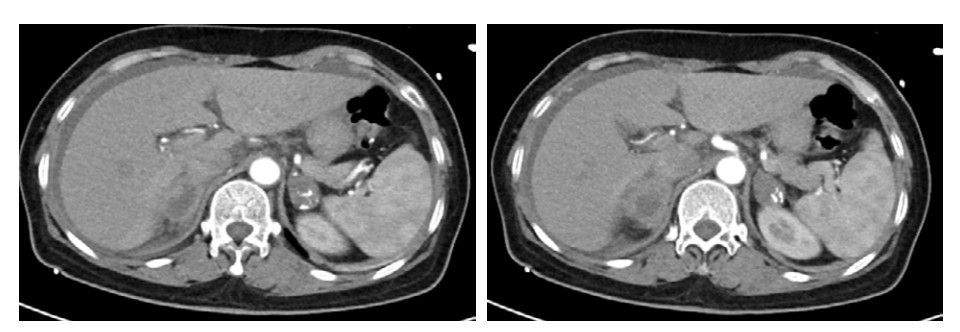
|
| 图 2 腹部增强CT双侧肾上腺强化不均伴有点状钙化灶 |
|
|
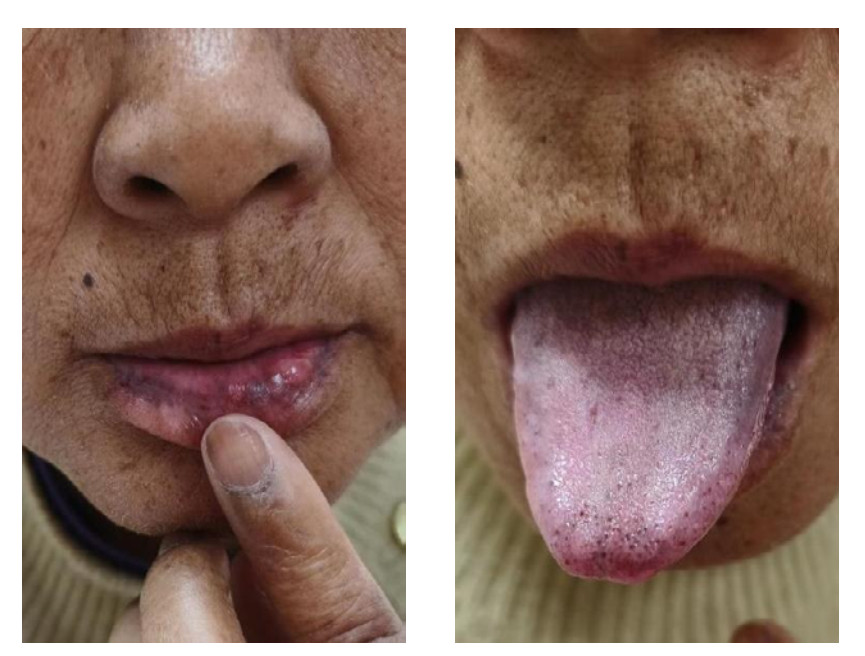
|
| 图 3 患者口唇和舌黏膜片状色素沉着 |
|
|
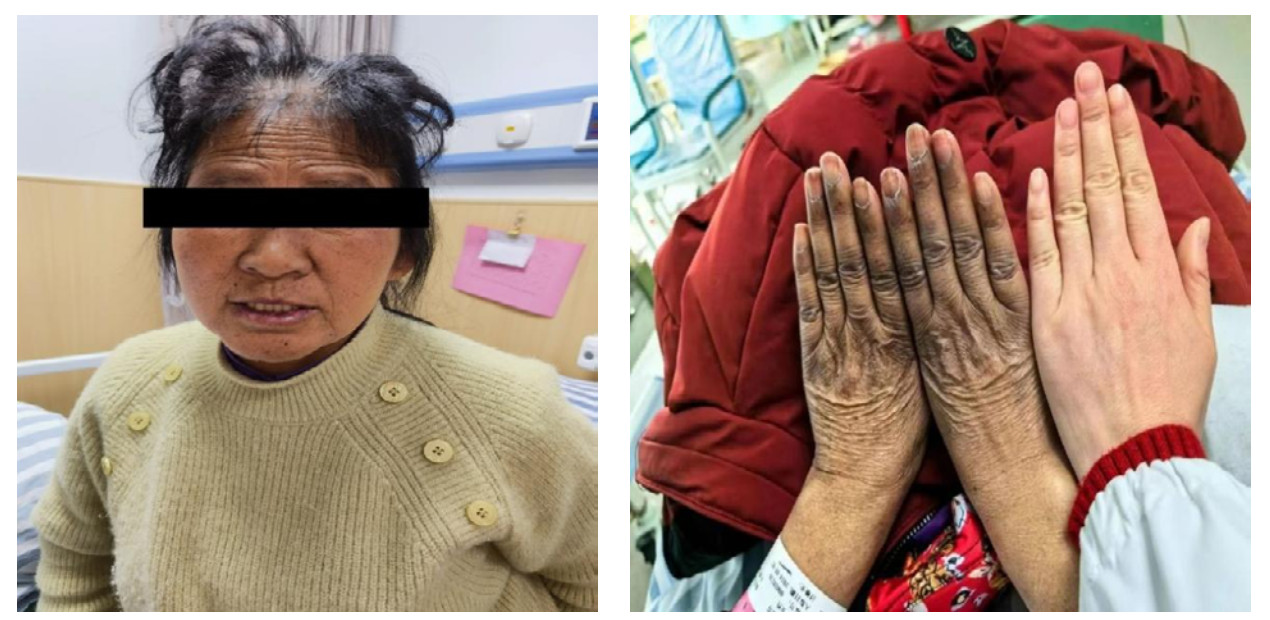
|
| 图 4 患者脸颊及手指关节处可见黑色素沉着 |
|
|
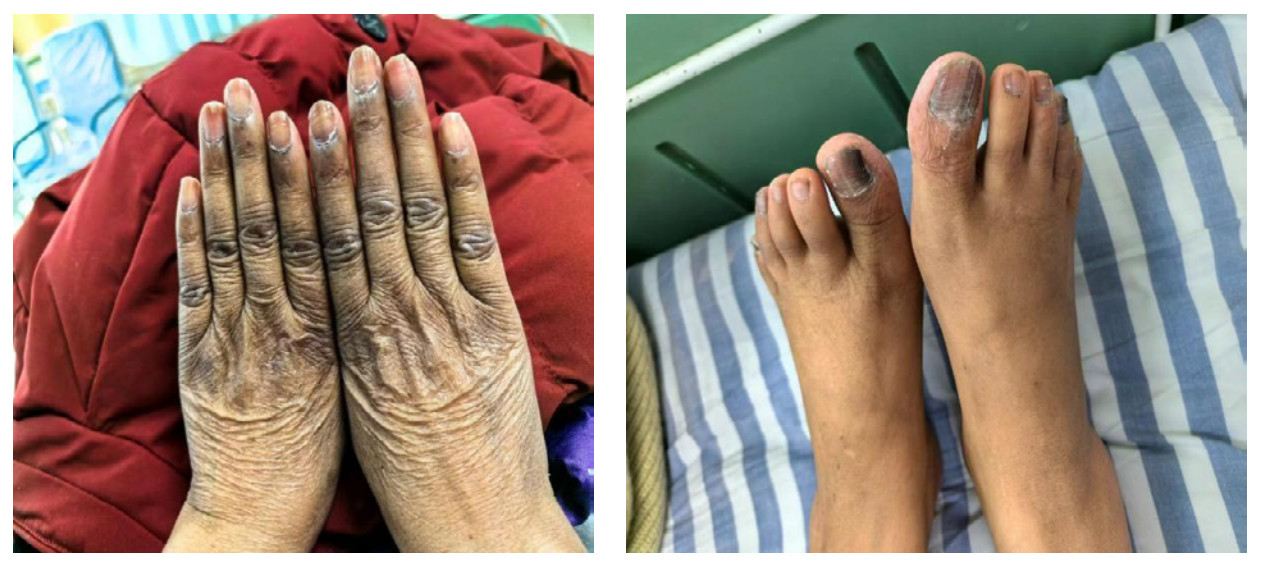
|
| 图 5 患者指甲有纵向条带状色素沉着 |
|
|
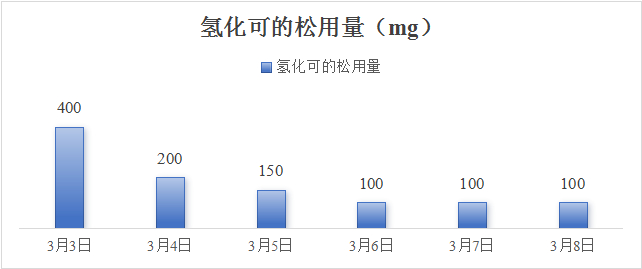
|
| 图 6 住院期间氢化可的松每日用量 |
|
|
文献报道近50%AC患者住院后方被确诊[3-4]。目前我国关于AC的发病率尚无具体数据,查阅知网、万方及维普三大数据库,2000-2024年期间共计报道艾迪森危象276例,诱发因素主要为感染(30.8%)、糖皮质激素的减量及停药(24.6%)、手术应激(14.9%),无明显诱因占比1.1%,经统计AC误诊率达55.8%。原发性肾上腺皮质功能减退症(PAI)国外常见病因为自身免疫性肾上腺炎,国内仍然为肾上腺结核[5]。而AC最常见的诱因是感染性疾病,外科手术和心理压力也是常见诱发因素[6]。AC常见临床表现包括虚弱、易疲劳、体重减轻、恶心、呕吐、腹痛、食欲下降、背部或肢体疼痛、头晕、意识改变、发热、血压下降[7-8],而原发性艾迪森危象患者除上述表现外,还会出现皮肤和颊黏膜色素沉着过度和瘢痕形成等体征[9]。由于疾病的罕见性和症状的非特异性,AC的诊断通常存在延迟甚至漏诊。一项针对AI患者的横断面研究中,50%的患者在症状出现后的6个月内才被诊断出来,其中20% 的患者在出现症状五年后才被诊断,误诊率达68%[10]。同样,在挪威的一项大型研究中,大约50% 的AI患者在出现症状后6个月才被明确诊断,其中64% 的患者仅在急诊住院后才被诊断出[11]。
肾上腺危象是一种临床诊断,目前尚缺乏统一定义,2015年Allolio等[12]提出肾上腺危象定义:①总体健康状态严重受损同时合并至少两种以下临床表现:低血压(收缩压 < 100 mmHg)、恶心或呕吐、严重疲劳、低钠血症(≤132 mmol/l)、低血糖和高钾血症;②胃肠外糖皮质激素给药后的临床症状改善。2017年Rushworth等[13]提出肾上腺危象的定义:①低血压(收缩压 < 100 mmHg或收缩压比患者正常的基线下降≥20 mmHg);②常有伴随腹痛、谵妄、低钠血症、高钾血症、低血糖、发热等;③上诉临床表现通常在给予静脉糖皮质激素后1~2 h内改善和消失。AC诊断依据主要靠病史采集、临床表现和随机血清皮质醇和ACTH浓度。ACTH超过正常上限的两倍,皮质醇 < 80~140 nmol/L提示原发性肾上腺皮质功能减退症[14]。而ACTH < 5 pg/mL,皮质醇 < 138 nmol/L,ACTH兴奋试验正常或低于正常提示继发性肾上腺皮质功能减退症。本例AC急诊,晨8:00测血皮质醇为14.96 ng/mL、低于正常均数的10倍,ACTH达1 096 ng/mL,高于正常值近24倍,说明该患者病情严重处于危象状态,为原发性肾上腺功能减退。肾上腺危象处理不及时会带来病死率的增加,临床上一旦怀疑肾上腺危象,应立即留取血标本送检皮质醇和ACTH,无需等待检验结果[15],即刻给予氢化可的松,是治疗肾上腺危象的首选药物,紧急治疗时应静脉或肌肉注射氢化可的松100 mg,此后给予氢化可的松200 mg/24 h维持,使其产生稳定的皮质醇水平[14]。一旦临床症状改善,建议开始逐渐减量糖皮质激素的应用[16]。除激素治疗外,还应给予积极充分的液体复苏,同时维持内环境的稳定。
本文报道的病例发生误诊误治分析原因如下:①发病隐匿:该患者两年来逐渐出现肢体乏力伴皮肤色素沉着,体重缓慢下降,未予重视,最终以恶心呕吐为首发症状并出现意识障碍伴血压下降才入院治疗。整体病程长,发病早期无明显阳性体征,患者本身易忽视,急诊医师问诊时同样容易遗漏。②由于低热和消化道症状,一线医师诊断为脓毒性休克,出现误诊误治。AC临床表现有两种状态,其一、表现为恶心呕吐、腹痛、谵妄、低钠血症、高钾血症、低血糖、发热、休克等,可伴有白细胞增高,但不合并感染,如本例情况,多见于肾上腺皮质功能明显低下者。其二、AI患者合并感染诱发AC发生,此时鉴别诊断较为困难,除AC的表现外,还合并有感染的征象,此时对于感染相关的依据应该积极寻找,可按脓毒性休克指南规范进行,同时积极寻找感染灶,其中PCT、乳酸、凝血功能、病原学检查如血培养、mNGS等。两者治疗的共同点均要及时补充适量糖皮质激素。该患者危象入院后查PCT及白细胞均在正常范围内,无感染症状,近期亦无其他应激事件发生,发生无明显诱因可循。但近1个月恶心呕吐症状进行性加重,形成恶性循环,最终导致肾上腺危象。在给予糖皮质激素后临床表现逐渐改善,循环逐渐恢复正常。该患者考虑AC后,未第一时间使用激素治疗,在第2日早八点留取血皮质醇及促肾上腺皮质激素标本后使用氢化可的松治疗,病情2 h左右改善。同时患者T-spot结果阳性,CT提示两上肺钙化灶(见图 1),双侧肾上腺占位伴钙化。由于无肺结核感染症状,故考虑原发性肾上腺结核可能,建议为明确病因可行肾上腺穿刺活检,同时经验性行抗结核治疗,但患者无盗汗、低热等感染症状,患者本人及家属拒绝活检及抗结核治疗,最终未能明确诊断。
由于AC属于罕见病,急诊医生和基层医师往往认识不足,易发生误诊、漏诊和误治,带来临床风险。肾上腺危象病情危急,临床表现缺乏特异性,对于既往无肾上腺皮质功能减退症病史的患者,出现以下临床表现时,需警惕肾上腺危象:①频繁呕吐、腹泻或腹痛;②发热、白细胞增高但用抗生素治疗无效;③难治性休克;④反复低钠血症及低血糖发作;⑤不能解释的精神萎靡、乏力、虚脱或衰弱与病情不成比例,且出现逐渐加深的皮肤色素沉着。急诊医生应加强对本病的认识,对于怀疑肾上腺危象的患者第一时间留取血标本,随后给予糖皮质激素替代治疗治疗,可改善患者的预后。
利益冲突 所有作者声明无利益冲突
作者贡献声明 曹雪婷:论文撰写;金海康、陆殿霞、赵亚丽:数据收集及整理;王吉、张劲松:论文指导和修正
| [1] | White K, Arlt W. Adrenal crisis in treated Addison's disease: a predictable but under-managed event[J]. Eur J Endocrinol, 2010, 162(1): 115-120. DOI:10.1530/EJE-09-0559 |
| [2] | Charmandari E, Nicolaides NC, Chrousos GP. Adrenal insufficiency[J]. Lancet, 2014, 383(9935): 2152-2167. DOI:10.1016/S0140-6736(13)61684-0 |
| [3] | Papierska L, Rabijewski M. Delay in diagnosis of adrenal insufficiency is a frequent cause of adrenal crisis[J]. Int J Endocrinol, 2013, 2013: 482370. DOI:10.1155/2013/482370 |
| [4] | Younes N, Bourdeau I, Lacroix A. Latent adrenal insufficiency: from concept to diagnosis[J]. Front Endocrinol, 2021, 12: 720769. DOI:10.3389/fendo.2021.720769 |
| [5] | 卢亚男, 李伟, 李玉秀, 等. 抗结核治疗中诊断Addison病1例报告并文献复习[J]. 中国实用内科杂志, 2020, 40(5): 438-440. DOI:10.19538/j.nk202005019 |
| [6] | Hahner S. Acute adrenal crisis and mortality in adrenal insufficiency: Still a concern in 2018![J]. Ann Endocrinol, 2018, 79(3): 164-166. DOI:10.1016/j.ando.2018.04.015 |
| [7] | Claessen KMJA, Andela CD, Biermasz NR, et al. Clinical unmet needs in the treatment of adrenal crisis: importance of the patient's perspective[J]. Front Endocrinol, 2021, 12: 701365. DOI:10.3389/fendo.2021.701365 |
| [8] | Rushworth RL, Torpy DJ, Falhammar H. Adrenal crisis[J]. N Engl J Med, 2019, 381(9): 852-861. DOI:10.1056/NEJMra1807486 |
| [9] | Dineen R, Thompson CJ, Sherlock M. Adrenal crisis: prevention and management in adult patients[J]. Ther Adv Endocrinol Metab, 2019, 10: 2042018819848218. DOI:10.1177/2042018819848218 |
| [10] | Bleicken B, Hahner S, Ventz M, et al. Delayed diagnosis of adrenal insufficiency is common: a cross-sectional study in 216 patients[J]. Am J Med Sci, 2010, 339(6): 525-531. DOI:10.1097/MAJ.0b013e3181db6b7a |
| [11] | Erichsen MM, Løvås K, Skinningsrud B, et al. Clinical, immunological, and genetic features of autoimmune primary adrenal insufficiency: observations from a Norwegian registry[J]. J Clin Endocrinol Metab, 2009, 94(12): 4882-4890. DOI:10.1210/jc.2009-1368 |
| [12] | Allolio B. Extensive expertise in endocrinology. Adrenal crisis[J]. Eur J Endocrinol, 2015, 172(3): R115-R124. DOI:10.1530/EJE-14-0824 |
| [13] | Rushworth RL, Torpy DJ, Falhammar H. Adrenal crises: perspectives and research directions[J]. Endocrine, 2017, 55(2): 336-345. DOI:10.1007/s12020-016-1204-2 |
| [14] | Bornstein SR, Allolio B, Arlt W, et al. Diagnosis and treatment of primary adrenal insufficiency: an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab, 2016, 101(2): 364-389. DOI:10.1210/jc.2015-1710 |
| [15] | Dineen R, Stewart PM, Sherlock M. Factors impacting on the action of glucocorticoids in patients receiving glucocorticoid therapy[J]. Clin Endocrinol, 2019, 90(1): 3-14. DOI:10.1111/cen.13837 |
| [16] | Guignat L. Therapeutic patient education in adrenal insufficiency[J]. Ann Endocrinol, 2018, 79(3): 167-173. DOI:10.1016/j.ando.2018.03.002 |
 2024, Vol. 33
2024, Vol. 33




