2. 苏州大学附属第二医院消化科,苏州 215004;
3. 北京推想医疗科技有限公司,北京 100025
2. Gastroenterology Department, The Second Affiliated Hospital of Soochow University, Suzhou, 215004, China;
3. Infervision Medical Technology Co., Ltd, Beijing 100025, China
急性胰腺炎(acute pancreatitis, AP)是临床常见的急腹症,病程复杂多变,病情轻重不等,2012年修订版亚特兰大共识[1]将AP按严重程度分为轻症、中度重症和重症。据统计,约20%的患者会发展为重症急性胰腺炎(severe acute pancreatitis,SAP),病死率高达20%~40%[2-3]。因此,早期评估AP病情严重程度、识别可能发展为SAP的患者对于临床及时干预和改善患者预后有重要意义。
经过众多学者不断的研究探索,产生了许多临床和影像方面评估AP严重程度的评分系统,如Ranson评分、急性生理学与慢性健康评估Ⅱ(acute physiology and chronic health evaluation, APACHE-Ⅱ)和改良的CT严重程度指数(modified computed tomography severity index, MCTSI)等,但这些评分系统都有一些局限性,包括敏感度低、过程复杂繁琐等而难以在临床上广泛应用[4-5]。目前,放射科医生主要通过观察胰腺及胰周的改变来评估AP的严重程度,但部分患者发病早期的形态变化,尤其是胰腺坏死在影像上表现并不显著,这将可能引起病情的低估[6]。近年来影像组学发展迅速,它突破了传统影像学基于形态学特征和半定量分析的模式,通过高通量算法提取图像的定量特征,可以挖掘到大量肉眼无法观察到的潜在信息,从而提高诊断的准确性[7-9]。目前有关于AP的影像组学研究见于预测疾病进展[10]、复发[11]及MRI评价严重程度[12]等方面,而基于增强CT影像组学联合临床指标预测严重程度方面鲜有报道。故本研究拟纳入CT影像组学特征及临床试验室指标等多个参数建立联合的Nomogram模型,探讨其在早期预测AP病情严重程度中的价值。
1 资料与方法 1.1 研究对象回顾性收集苏州大学附属第二医院2016年1月至2023年3月的AP患者,AP的诊断根据2012年修订版亚特兰大急性胰腺炎分类和定义[1]。纳入标准:(1)首次发病;(2)发病早期(1周内)行腹部CT平扫和增强检查;(3)完善入院48 h内的血清学检查和48 h后C-反应蛋白指标。排除标准:(1)合并胰腺肿瘤或其他感染性病变;(2)图像质量不佳影响观察或增强CT时间超过1周;(3)相关实验室检查不全。根据亚特兰大分级,将所有患者分为轻症组、中度重症组及重症(SAP)组。由于中度重症者的器官衰竭在48 h内可以自行恢复,故将轻症和中度重症纳入非重症(Non-SAP,NSAP)组。将患者按7∶3的比例随机分为训练组和验证组。本研究经过苏州大学附属第二医院医院伦理委员会审查通过(伦理批号:JD-HG-2023-73)。
1.2 临床资料收集所有患者的临床资料及相关的实验室检查。包括性别、年龄、病因、饮酒史、吸烟史、高血压、糖尿病;C-反应蛋白(C-reactive protein, CRP)、尿素氮、肌酐、血钙、乳酸脱氢酶(lactate dehydrogenase, LDH)、白蛋白、谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、D-二聚体、白细胞计数、中性粒细胞比率、血红蛋白、红细胞压积、血小板计数等。
1.3 检查方法所有患者均在GE Discovery CT750 HD 64排螺旋CT机上行腹部轴位平扫和增强扫描,增强造影剂采用非离子型对比剂碘海醇(300 mg I/mL),以3.5 mL/s的速度经肘静脉高压注射,剂量为1.6 mL/kg。增强扫描采用智能触发技术,当腹主动脉的CT值达到150 HU时开始动脉期扫描,静脉期和延迟期分别在30 s后和120 s后进行。扫描参数为管电压120 kV、自动管电流、旋转时间0.6 s、螺距0.938、FOV 500 mm×500 mm、层厚5 mm、层间距5 mm、矩阵512×512。
1.4 图像分析由2名放射科诊断医师共同在PACS系统上阅片,根据CT征象进行MCTSI评分、Balthazar分级和胰腺外炎症CT评分(extrapancreatic inflammation on CT,EPIC),以上三种评分为目前最常见的用于评估AP严重程度方面的影像学评分系统,意见不一致时协商解决。
1.5 感兴趣区域的勾画以及影像组学特征的提取和选择将所有患者的平扫、动脉期、静脉期和延迟期CT图像以DICOM格式从PACS中导出,选择窗宽400 HU、窗位50 HU对图像灰度进行标准化处理。由一名有3年腹部诊断经验的放射科医师使用ITK-SNAP(v3.8.0)软件分别在各期图像上沿胰腺实质边缘连续逐层勾画感兴趣区域(region of interest,ROI),包括胰腺坏死部分,避开支架、胆总管、大血管和钙化。勾画完成后的ROI由另一位有20年以上诊断经验的主任医师依次确认。使用开源python包(PyRadiomics 3.0.1版)从3D感兴趣体积中提取影像组学特征,使用最小绝对收缩与选择算子(least absolute shrinkage and selection operator,LASSO)回归和10折交叉验证法筛选出最优影像组学特征,分别构建影像组学标签。
1.6 统计学方法采用SPSS 26.0软件进行统计学分析。计量资料采用Shapiro-Wilk进行正态性检验,符合正态分布的使用均数±标准差(x±s)表示,两组间的比较采用独立样本t检验;非正态分布的以中位数(第1四分位数,第3四分位数)[M(Q1,Q3)]表示,组间比较采用Mann-Whitney U检验。计数资料表示为频数(n)和百分比(%),并使用χ2检验或Fisher确切概率法比较。应用二元Logistic单因素及多因素分析筛选出SAP的临床独立危险因素。运用受试者工作特征(receiver operating characteristic curve, ROC)曲线分析,计算曲线下面积(area under curve, AUC),通过DeLong检验比较不同模型的预测性能。运用校准曲线和Hosmer–Lemeshow检验评价模型的拟合优度。运用决策曲线分析(decision curve analysis,DCA)评估模型的临床净收益,以P<0.05为差异有统计学意义。
2 结果 2.1 临床特征的比较及临床模型的建立最终入组AP患者205例(SAP 59例,NSAP 146例),将所有患者按7∶3的比例随机(随机数字法)分为训练组(144例,SAP 40例,NSAP 104例)和验证组(61例,SAP 19例,NSAP 42例)。在训练组中,SAP组与NSAP组患者间CRP、血钙、白蛋白、肌酐、尿素氮、LDH、D-二聚体、白细胞计数和中性粒细胞比率差异有统计学意义(P < 0.05),在验证组中,两组患者间CRP、血钙、肌酐、尿素氮、LDH和D-二聚体差异有统计学意义(P < 0.05),其余临床特征及实验室指标差异均无统计学意义(P > 0.05)(见表 1)。单因素及多因素Logistic回归显示CRP(OR=1.010,95%CI: 1.006~1.015,P < 0.001)和LDH(OR=1.002,95%CI: 1.001~1.004,P=0.001)是SAP的独立预测因子。联合CRP和LDH构建临床模型,其在训练组和验证组中的AUC分别为0.879和0.889,见表 2。
| 临床资料及指标 | 训练组(n=144) | 统计值 | P值 | 验证组(n=61) | 统计值 | P值 | ||
| SAP(n=40) | NSAP(n=104) | SAP(n=19) | NSAP(n=42) | |||||
| 性别a | 0.277 | 0.599 | 0.071 | 0.789 | ||||
| 男 | 28(70.0) | 68(65.4) | 12(63.2) | 28(66.7) | ||||
| 女 | 12(30.0) | 36(34.6) | 7(36.8) | 14(33.3) | ||||
| 年龄(岁)b, c | 48.00(38.00,54.75) | 49.50(35.00,63.00) | -0.025 | 0.980 | 47.05 ± 17.87 | 48.00 ± 16.15 | 0.205 | 0.838 |
| 病因a | 3.220 | 0.352 | 6.787 | 0.064 | ||||
| 胆源性 | 14(35.0) | 48(46.2) | 8(42.1) | 16(38.1) | ||||
| 高脂血症性 | 15(37.5) | 24(23.1) | 8(42.1) | 15(35.7) | ||||
| 酒精性 | 1(2.5) | 5(4.8) | 8(42.1) | 0(0.0) | ||||
| 其他病因 | 10(25.0) | 27(26.0) | 1(5.3) | 11(26.2) | ||||
| 高血压a | 14(35.0) | 39(37.5) | 0.078 | 0.781 | 9(47.4) | 10(23.8) | 3.386 | 0.066 |
| 糖尿病a | 10(25.0) | 20(19.2) | 0.583 | 0.445 | 3(15.8) | 9(21.4) | 0.027 | 0.869 |
| 饮酒a | 11(27.5) | 26(25.0) | 0.095 | 0.758 | 4(21.1) | 16(38.1) | 1.724 | 0.189 |
| 吸烟a | 12(30.0) | 29(27.9) | 0.063 | 0.801 | 4(21.1) | 12(28.6) | 0.092 | 0.761 |
| CRP(mg/L)b | 301.70(197.05,339.45) | 116.10(51.75 172.55) | -6.831 | < 0.001 | 247.00(186.70,374.20) | 116.45(64.75,211.08) | -3.862 | < 0.001 |
| 血钙(mmol/L)b | 1.88(1.52,2.05) | 2.12(1.99,2.23) | -5.166 | < 0.001 | 1.88(1.67,2.01) | 2.09(2.00,2.25) | -4.082 | < 0.001 |
| 白蛋白(g/L)c, b | 33.15 ± 6.09 | 38.58 ± 4.95 | 5.523 | < 0.001 | 31.10(31.50,38.10) | 38.30(32.08,41.03) | -1.916 | 0.055 |
| ALT(U/L)b | 59.00(31.25,150.75) | 101.50(27.00,409.50) | -0.941 | 0.347 | 49.00(23.00,251.00) | 65.50(32.75,207.25) | -0.623 | 0.533 |
| AST(U/L)b | 71.00(38.00,172.00) | 54.50(26.00,243.00) | -1.162 | 0.245 | 68.00(29.00,230.00) | 36.50(24.00,259.75) | -0.436 | 0.663 |
| 尿素氮(mmol/L)b | 8.10(4.73,11.18) | 4.70(3.60,6.05) | -4.856 | < 0.001 | 6.40(4.30,7.80) | 4.65(3.18,5.50) | -2.501 | 0.012 |
| 肌酐(μmol/L)b | 86.50(54.50,154.75) | 66.00(55.00,78.75) | -3.092 | 0.002 | 70.00(62.00,90.00) | 60.00(48.00,68.25) | -2.322 | 0.020 |
| LDH(U/L)b | 570.50(333.00,798.25) | 230.50(185.25,341.00) | -5.814 | < 0.001 | 452.00(341.00,732.00) | 231.50(193.00,345.25) | -3.878 | < 0.001 |
| D-二聚体(μg/mL)b | 4.43(2.10,9.80) | 1.58(1.02,2.96) | -4.434 | < 0.001 | 3.35(1.69,6.70) | 1.57(0.60,2.99) | -2.570 | 0.010 |
| 白细胞计数(109/L)c | 15.37 ± 6.18 | 13.04 ± 4.38 | -2.178 | 0.034 | 14.72 ± 5.15 | 13.57 ± 3.61 | -0.879 | 0.387 |
| 中性粒细胞比率b | 89.95(85.53,92.68) | 84.45(78.73,89.03) | -3.700 | < 0.001 | 87.90(82.90,90.70) | 83.60(79.68,87.43) | -1.783 | 0.075 |
| 血红蛋白(g/L)c, b | 156.70 ± 30.58 | 150.20 ± 22.04 | -1.415 | 0.159 | 149.00(134.00,164.00) | 151.50(139.75,164.00) | -0.016 | 0.988 |
| 红细胞压积(%)c | 45.44 ± 8.08 | 44.17 ± 5.47 | -0.915 | 0.364 | 43.77 ± 8.06 | 43.90 ± 5.12 | 0.065 | 0.949 |
| 平均血红蛋白浓度(g/L)b | 341.00(329.25,351.00) | 337.50(329.00,348.00) | -1.178 | 0.239 | 339.00(332.00,350.00) | 338.50(329.00,350.25) | -0.592 | 0.554 |
| 血小板计数(109/L)c | 213.85 ± 64.38 | 221.63 ± 66.99 | 0.630 | 0.529 | 235.37 ± 93.32 | 223.81 ± 67.84 | -0.546 | 0.587 |
| 注:CRP为C-反应蛋白;AST为谷草转氨酶;ALT为谷丙转氨酶;LDH为乳酸脱氢酶;a数值表示为[例(%)],b数值表示为M(Q1,Q3),c数值表示为x±s | ||||||||
| 模型 | AUC (95% CI) | P值 | 敏感度 | 特异度 | PPV | NPV |
| 训练组 | ||||||
| 动脉期模型 | 0.937(0.884~0.971) | 0.294 | 0.878 | 0.892 | 0.766 | 0.948 |
| 静脉期模型 | 0.917(0.859~0.956) | 0.141 | 0.829 | 0.931 | 0.829 | 0.931 |
| 延迟期模型 | 0.918(0.860~0.957) | 0.122 | 0.902 | 0.814 | 0.661 | 0.954 |
| 平扫模型 | 0.915(0.857~0.955) | 0.041 | 0.829 | 0.912 | 0.791 | 0.930 |
| 临床模型 | 0.879(0.813~0.927) | 0.004 | 0.781 | 0.882 | 0.727 | 0.909 |
| MCTSI | 0.852(0.784~0.906) | 0.010 | 0.683 | 0.882 | 0.700 | 0.874 |
| Balthazar | 0.904(0.844~0.947) | 0.099 | 0.878 | 0.833 | 0.679 | 0.944 |
| EPIC | 0.861(0.793~0.913) | 0.020 | 0.854 | 0.794 | 0.625 | 0.931 |
| Nomogram模型 | 0.956(0.908~0.983) | reference | 0.829 | 0.961 | 0.895 | 0.933 |
| 验证组 | ||||||
| 动脉期模型 | 0.913(0.813~0.970) | 0.062 | 0.944 | 0.773 | 0.630 | 0.971 |
| 静脉期模型 | 0.902(0.799~0.963) | 0.109 | 0.722 | 1.00 | 1.00 | 0.898 |
| 延迟期模型 | 0.880(0.772~0.949) | 0.059 | 0.778 | 0.974 | 0.933 | 0.915 |
| 平扫模型 | 0.878(0.769~0.947) | 0.049 | 0.889 | 0.800 | 0.640 | 0.946 |
| 临床模型 | 0.889(0.783~0.955) | 0.097 | 0.889 | 0.800 | 0.640 | 0.946 |
| MCTSI | 0.834(0.718~0.916) | 0.023 | 0.722 | 0.909 | 0.765 | 0.889 |
| Balthazar | 0.852(0.739~0.930) | 0.081 | 0.889 | 0.727 | 0.571 | 0.941 |
| EPIC | 0.847(0.733~0.926) | 0.056 | 0.944 | 0.636 | 0.515 | 0.966 |
| Nomogram模型 | 0.947(0.859~0.988) | reference | 0.889 | 0.886 | 0.762 | 0.951 |
| 注:AUC:曲线下面积;95%CI可信区间;PPV:阳性预测值;NPV:阴性预测值 | ||||||
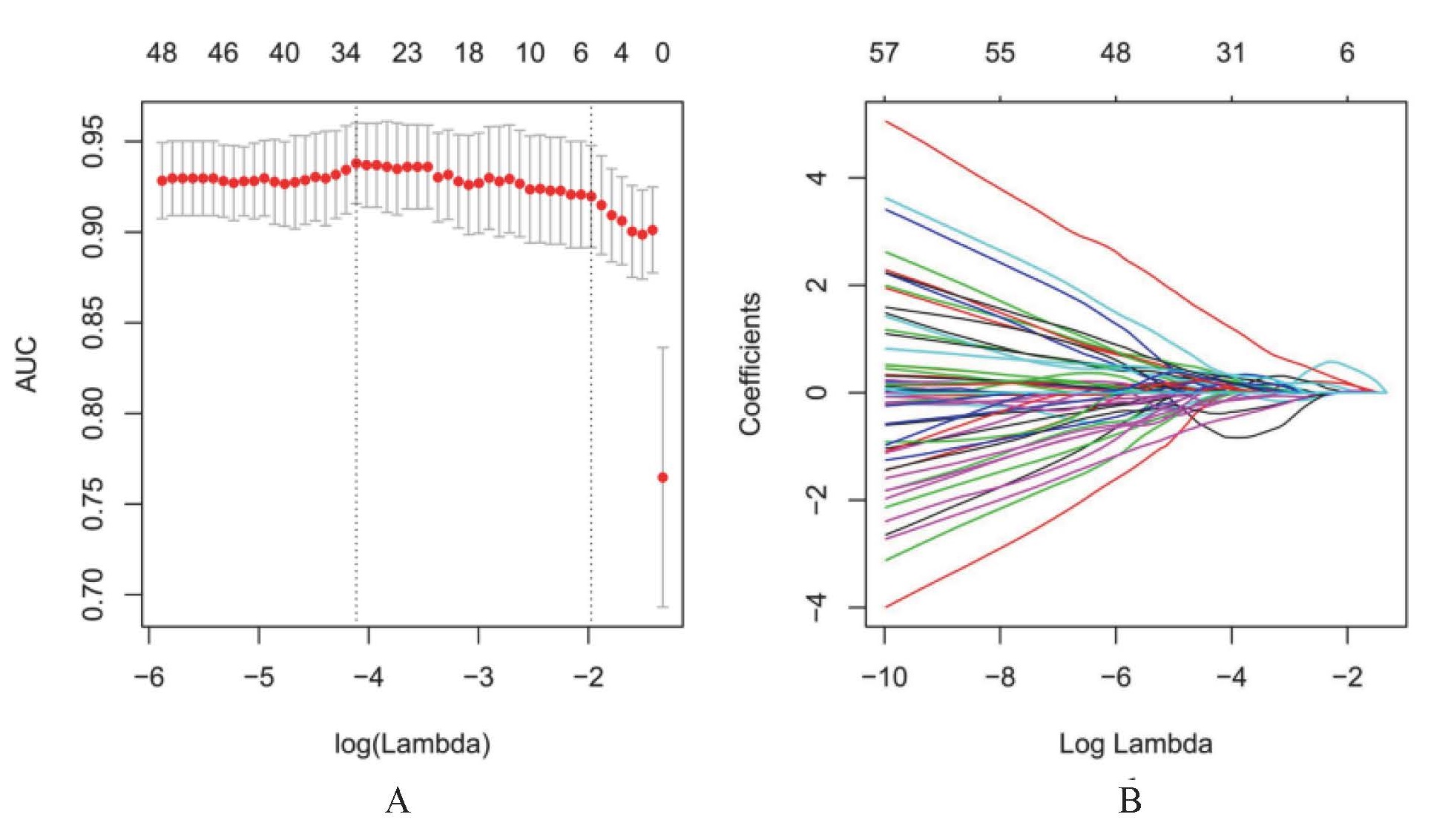
共有1 746个影像组学特征被提取,包括17个形态特征、323个一阶强度特征和1406个纹理特征,通过LASSO回归及十折交叉验证法分别从平扫、动脉期、静脉期和延迟期图像中筛选出3、5、5、5个最优组学特征, 见图 1;分别建立影像组学标签,并绘制了关键特征的热图, 见图 2。通过ROC曲线分析,动脉期影像组学标签与平扫、静脉期和延迟期相比,在训练组和验证组中具有更好的预测性能,AUC分别为0.937和0.913, 见表 2。
|
| A; LOSSO回归筛选动脉期最优影像组学特征;B: 动脉期不同纹理特征在LASSO的收敛系数图 图 1 采用LOSSO回归进行特征筛选 Fig 1 Select the radiomics features by LOSSO regression |
|
|

|
| 图 2 不同期相筛选出的影像组学特征生成的热图 Fig 2 Heat map generated from selected radiomics features in different phases |
|
|
将最优影像组学标签(动脉期标签)与临床独立危险因素(CRP和LDH)整合,建立Nomogram联合模型(如图 3)。ROC曲线显示,Nomogram模型在训练组和验证组中的AUC分别为0.956和0.947,高于单独的影像组学模型和临床模型(如图 4)。DeLong检验结果显示,训练组中Nomogram模型的预测效能与平扫模型和临床模型之间差异有统计学意义,P值分别为0.041和0.004;与动脉期、静脉期和延迟期的影像组学模型之间差异无统计学意义(P均>0.05)。各模型的具体指标比较见表 2。经HosmerLemeshow检验,训练组和验证组中Nomogram模型的校准曲线,见图 5,均具有良好的拟合效果(训练组P=0.140,验证组P=0.860)。DCA显示动脉期影像组学标签和Nomogram模型的临床净收益均优于临床模型,且Nomogram模型更好,见图 6。

|
| 图 3 CT影像组学-临床指标联合的Nomogram模型 Fig 3 The Nomogram model based on CT radiomics and clinicalIndicators |
|
|

|
| A: 训练组;B: 验证组 图 4 动脉期影像组学模型、临床模型、Nomogram模型的ROC曲线 Fig 4 ROC curves of radiomics model in arterial phase, clinical model and Nomogram mode |
|
|

|
| A: 训练组;B: 验证组 图 5 Nomogram模型的校准曲线 Fig 5 Calibration curve of Nomogram model |
|
|

|
| A: 训练组;B: 验证组 图 6 动脉期影像组学模型、临床模型和Nomogram模型预测AP严重程度的决策曲线分析(DCA) Fig 6 Decision curve analysis of radiomics model, clinical model and Nomogram model in arterial phase to predict the severity of AP |
|
|
在训练组中,MCTSI评分、Balthazar分级和EPIC评分的AUC分别为0.852、0.904和0.861,在验证组中为0.834、0.852和0.847。两组的Nomogram模型与三种评分系统相比预测SAP的AUC均最高(如图 7)。

|
| A: 训练组;B: 验证组 图 7 Nomogram模型与MCTSI评分、Balthazar分级、EPIC评分的ROC曲线 Fig 7 ROC curve of Nomogram model and MCTSI score, Balthazar grade, EPIC score, (a) training group; (b)validation group |
|
|
本研究结果表明基于CT影像组学-临床指标联合建立的Nomogram模型早期预测AP患者的严重程度的效能明显优于临床预测模型以及三种常用影像学评分,可以为临床治疗决策提供更为可靠的参考。
本研究纳入的多种有潜在预测价值的临床资料和实验室指标中,CRP和LDH是SAP的独立预测因子。CRP是一种急性期反应蛋白,在炎症感染或创伤时迅速升高[13]。指南及相关研究[14-15]表明,AP患者入院后48 h CRP水平 > 150 mg/L对于预测病情严重程度具有很高的敏感性,且CRP水平与AP严重程度呈正相关。本研究中,SAP组CRP水平明显高于NSAP组,这与Mayer等[16]以及Beger等[17]的研究结果一致。LDH是无氧氧化的关键酶,在组织损伤、坏死或恶性肿瘤中均可升高[18-20],LDH出现在细胞外时表明细胞完整性的破坏,可作为细胞死亡的标志物。Komolafe等[21]认为LDH可用于水肿性胰腺炎和坏死性胰腺炎的鉴别。Cui等[22]的研究显示LDH是AP发生持续性器官衰竭的独立危险因素。本研究中,LDH是SAP的独立预测因子,这可能是由于SAP患者体内大量免疫细胞激活,导致血管内皮细胞受损,胰腺微循环障碍,组织缺血缺氧坏死,同时大量免疫细胞参与全身炎症反应,进而引起器官功能障碍。结合CRP和LDH建立的临床模型在训练组和验证组中的AUC分别为0.879和0.889。
早期AP的常规影像学表现往往类似,但不同严重程度的AP胰腺实质改变存在差异,轻症者发病早期伴有高灌注,而重症者则存在进行性灌注减少和组织缺血,这些潜在的异质性信息可以通过影像组学特征反映出来。Lin等[12]从MRI静脉期图像中提取了11个组学特征构建模型,其在训练组中的AUC为0.917,效能优于APACHEⅡ评分、BISAP评分和MCTSI评分。本研究分别从平扫、动脉期、静脉期及延迟期的CT图像中筛选出3、5、5、5个最优影像组学特征,共包括1个形态特征、5个一阶特征、12个纹理特征(3个GLCM、5个GLRLM和4个GLSZM),形态特征反映了胰腺的大小、形状等;一阶特征反映了胰腺内不同灰度的频率分布情况;纹理特征描述的是多个体素灰度的空间分布,分别通过运行长度、灰度分布以及灰度强度值等反映了图像纹理的粗糙程度和非均质性,运行长度越长,灰度不均匀性越高,异质性越大。本研究中,SAP组的图像纹理更粗糙复杂,灰度分布更不均匀,存在高异质性,考虑与SAP复杂的病理变化有关,SAP更易发生出血、坏死,导致密度、强化不均匀,因而灰度不均。本研究通过各期相筛选的最优组学特征分别构建了平扫、动脉期、静脉期和延迟期的影像组学模型,预测性能都比较好,它们在训练组中AUC分别为0.915、0.937、0.917和0.918,性能优于MCTSI(0.852)、Balthazar分级(0.904)和EPIC评分(0.861)等影像上常用的评分系统以及临床模型(0.879),其中动脉期影像组学标签的预测性能相对更好,这可能是由于胰腺为多动脉供血器官,包括胃十二指肠动脉、肠系膜上动脉和脾动脉等,动脉期胰腺实质明显强化,更容易检出胰腺内的小范围缺血和灌注减少区。本研究中将平扫和增强三期的影像组学特征结合,其AUC值并没有提高,考虑原因是由于特征数量较多而样本量较少而引起了过拟合现象,今后需要更大的样本量进一步研究。由于AP的病程受到多种临床及病理生理因素的影响,本研究将动脉期影像组学标签与临床试验室指标联合建立Nomogram模型,其在训练组和验证组中的AUC分别为0.956和0.947,预测效能优于单独的影像组学模型和临床模型。校准曲线显示Nomogram模型的拟合度较好,说明该模型预测发生SAP的概率与实际的概率具有较好的一致性。DCA显示动脉期影像组学模型和Nomogram模型的临床净收益均高于临床模型,且Nomogram模型更好,具有良好的临床实用性。
本研究的局限性:(1)本研究为单中心回顾性研究,样本数量不够大;(2)手动勾画ROI费时耗力,且受主观因素影响。
利益冲突 所有作者声明无利益冲突
作者贡献声明 徐丹丹:研究设计、采集分析数据、论文撰写、论文修改;肖奥奇:采集数据、分析/解释数据;杨维森:数据整理、统计学分析;顾燕:统计学分析;金丹:分析数据;殷国建:收集数据、研究设计;印宏坤:分析处理数据、解释数据;范国华:行政支持、指导;沈钧康:对文章的知识性内容作批评性审阅;徐亮:研究设计、分析/解释数据、文章修改
| [1] | Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [2] | Boxhoorn L, Voermans RP, Bouwense SA, et al. Acute pancreatitis[J]. Lancet, 2020, 396(10252): 726-734. DOI:10.1016/S0140-6736(20)31310-6 |
| [3] | Gliem N, Ammer-Herrmenau C, Ellenrieder V, et al. Management of severe acute pancreatitis: an update[J]. Digestion, 2021, 102(4): 503-507. DOI:10.1159/000506830 |
| [4] | Harshit KA, Singh GM. A comparison of APACHEⅡ, BISAP, Ranson's score and modified CTSI in predicting the severity of acute pancreatitis based on the 2012 revised Atlanta Classification[J]. Gastroenterol Rep (Oxf), 2018, 6(2): 127-131. DOI:10.1093/gastro/gox029 |
| [5] | 盛雅琪, 朱华栋. 急性胰腺炎相关血清学指标及评分系统综述[J]. 中华急诊医学杂志, 2022, 31(5): 706-710. DOI:10.3760/cma.j.issn.1671-0282.2022.05.027 |
| [6] | Jin DX, McNabb-Baltar JY, Suleiman SL, et al. Early abdominal imaging remains over-utilized in acute pancreatitis[J]. Dig Dis Sci, 2017, 62(10): 2894-2899. DOI:10.1007/s10620-017-4720-x |
| [7] | Gillies RJ, Kinahan PE, Hricak H. Radiomics: images are more than pictures, they are data[J]. Radiology, 2016, 278(2): 563-577. DOI:10.1148/radiol.2015151169 |
| [8] | Scapicchio C, Gabelloni M, Barucci A, et al. A deep look into radiomics[J]. Radiol Med, 2021, 126(10): 1296-1311. DOI:10.1007/s11547-021-01389-x |
| [9] | Zhang X, Zhang Y, Zhang G, et al. Deep learning with radiomics for disease diagnosis and treatment: challenges and potential[J]. Front Oncol, 2022, 12: 773840. DOI:10.3389/fonc.2022.773840 |
| [10] | 范海云, 陈基明, 陈亮亮, 等. CT影像组学预测早期急性胰腺炎进展的价值[J]. 中华放射学杂志, 2022, 56(7): 778-784. DOI:10.3760/cma.j.cn112149-20210829-00615 |
| [11] | 黄晓东, 黄贤伟, 杨成彬, 等. 复发性高脂血症性急性胰腺炎列线图预测模型[J]. 中华急诊医学杂志, 2023, 32(10): 1346-1349. DOI:10.3760/cma.j.issn.1671-0282.2023.10.009 |
| [12] | Lin Q, Ji Y F, Chen Y, et al. Radiomics model of contrast-enhanced MRI for early prediction of acute pancreatitis severity[J]. J Magn Reson Imaging, 2020, 51(2): 397-406. DOI:10.1002/jmri.26798 |
| [13] | Tarar MY, Khalid A, Choo XY, et al. Use of the C-reactive protein (CRP)/albumin ratio as a severity tool in acute pancreatitis: systematic review[J]. Cureus, 2022, 14(9): e29243. DOI:10.7759/cureus.29243 |
| [14] | Dervenis C. Assessments of severity and management of acute pancreatitis based on the Santorini Consensus Conference report[J]. JOP, 2000, 1(4): 178-182. |
| [15] | Kim K, Kim SB. Predictors of severity of acute pancreatitis[J]. Gut Liver, 2023, 17(4): 493-494. DOI:10.5009/gnl230235 |
| [16] | Mayer AD, McMahon MJ, Bowen M, et al. C reactive protein: an aid to assessment and monitoring of acute pancreatitis[J]. J Clin Pathol, 1984, 37(2): 207-211. DOI:10.1136/jcp.37.2.207 |
| [17] | Beger H G, Isenmann R. Diagnosis, objective assessment of severity, and management of acute pancreatitis: Santorini Consensus Conference[J]. Int J Pancreatol, 1999, 26(1) 1-2, 2-3. DOI:10.1385/ijgc:26:1:1 |
| [18] | Elmoursi H, Abdalla M, Mesbah B E, et al. Salivary lactate dehydrogenase in relationship to the severity of hypoxic-ischemic encephalopathy among newborn infants[J]. Scientifica (Cairo), 2021, 2021: 9316277. DOI:10.1155/2021/9316277 |
| [19] | Jiang M, Qian H, Li Q, et al. Predictive value of lactate dehydrogenase combined with the abbreviated burn severity index for acute kidney injury and mortality in severe burn patients[J]. Burns, 2023. DOI:10.1016/j.burns.2023.01.012 |
| [20] | Comandatore A, Franczak M, Smolenski R T, et al. Lactate Dehydrogenase and its clinical significance in pancreatic and thoracic cancers[J]. Semin Cancer Biol, 2022, 86(Pt 2): 93-100. DOI:10.1016/j.semcancer.2022.09.001 |
| [21] | Komolafe O, Pereira S P, Davidson B R, et al. Serum C-reactive protein, procalcitonin, and lactate dehydrogenase for the diagnosis of pancreatic necrosis[J]. Cochrane Database Syst Rev, 2017, 4(4): CD12645. DOI:10.1002/14651858.CD012645 |
| [22] | Cui J, Xiong J, Zhang Y, et al. Serum lactate dehydrogenase is predictive of persistent organ failure in acute pancreatitis[J]. J Crit Care, 2017, 41: 161-165. DOI:10.1016/j.jcrc.2017.05.001 |
 2024, Vol. 33
2024, Vol. 33




