急性胰腺炎(acute pancreatitis, AP)是消化系统常见危急重症,具有发病率高、病情进展迅速、并发症多的特点,而急性肾损伤(acute kidney injury, AKI)是AP特别是急性重症胰腺炎常见的并发症。AKI已经成为AP预后不良的独立危险因素,显著延长患者住院时间和花费并增加患者病死率[1-2]。因此早期发现及预测AP肾损伤,继而早期干预,对于改善患者预后,提高治疗效果,具有极其重要的临床意义。既往研究证实的具有AP并发AKI预测价值的指标和临床评分系统,或是获取时间较长,或是需要在疾病过程中不定期收集复杂的信息,都不能实现早期预警的作用。因此本研究旨在根据患者发病早期的指标,建立AP并发AKI的早期预警模型,并进一步评价该模型的诊断价值。
1 资料与方法 1.1 研究对象本研究为单中心前瞻性研究,选取2022年1月至2022年12月在北京大学人民医院急诊科诊治的AP患者为研究对象,其中AP的诊断和分型符合《急性胰腺炎诊治指南2019》[3],AKI诊断根据《中国急性肾损伤临床实践指南》[4]推荐,存在以下特征之一者即为AKI:(1)48 h内血清肌酐(serum creatinine, Scr)上升/> 0.3 mg/dL(≥26.5 µmol/L);(2)Scr值在7 d内上升≥基础值的1.5倍;(3)持续6 h以上尿量 < 0.5 mL/(kg·h)。入选标准:(1)年龄 > 18岁;(2)发病24 h内入院,既往不存在慢性肾脏病病史,入院时未发生AKI;(3)相关临床资料完整。排除标准:(1)发病超过24 h;(2)入院前在其他医院已接受治疗;(3)基础存在慢性心功能不全、慢性肾脏病等影响基础肾功能的疾病;(4)入院时已发生AKI或者根据首次肾功能指标不能明确判断是否发生AKI。所有患者均依照病情发展接受及时的治疗与生命抢救措施。
本研究经过北京大学人民医院伦理审查委员会审查通过,审批编号为2021PHB060-001。
1.2 研究方法收集患者临床资料,包括患者的一般特征(年龄、性别、既往史等)、患者胰腺炎病因、就诊时的首次生命体征。所有患者均于发病24 h内采集血样,进行全血细胞分析、血生化指标、血气分析、凝血指标、感染指标等检测,根据患者空腹甘油三酯和葡萄糖计算甘油三酯-葡萄糖指数(triglyceride glucose index, TyG),根据患者全血细胞分析结果计算中性粒细胞/淋巴细胞比率(neutrophil-lymphocyte ratio, NLR)和血小板/淋巴细胞比率。收集全部患者的腹部CT结果并进行CT严重度指数(CT severity index, CTSI)评分。所有患者均在AP发病24 h内行AP床旁严重度指数(bedside index for severity in acute pancreatitis, BISAP)评分,急性生理学与慢性健康状况(acute physiology and chronic health evaluation, APACHE)Ⅱ评分,在发病24 h及48 h行Ranson评分。以诊断AP后14 d为观察终点,收集患者入院后是否发生浆膜腔积液、休克、急性呼吸窘迫综合征等并发症。
根据是否发生AKI分为AKI组和对照组。
1.3 统计学方法采用SPSS 27.0软件进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用成组t检验。非正态分布的计量资料以中位数及四分位数间距[M(Q1, Q3)]表示,组间比较采用Kruskal-wallis秩和检验。计数资料以例(百分率)表示,组间比较采用卡方检验或Fisher精确概率法。采用Logistic回归分析建立AP并发AKI的风险评估模型。计算所建模型的诊断敏感度、特异度,绘制受试者工作特征曲线(reciver operating characteristic curve, ROC)并计算曲线下面积(area under the curve, AUC),并与APACHE Ⅱ评分、Ranson评分、BISAP评分、CTSI评分的诊断价值进行比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 两组患者的一般资料及实验室指标比较本研究最终纳入AP患者258例,其中发生AKI患者79例[男性74.68%,年龄(61.78±17.71)岁],对照组患者179例[男性58.66%,年龄(47.55±16.65)岁]。两组患者相比,基础血肌酐及血尿素氮水平差异无统计学意义。AKI组患者既往患高血压的比例更高。AKI组患者PCT、NLR明显高于对照组,而ALP、白蛋白水平低于对照组。病情严重程度评分方面,AKI组患者Ranson评分、APACHEⅡ评分及BISAP评分均高于对照组,CTSI评分差异无统计学意义。远期并发症方面,AKI组患者在后期更多的合并ARDS及浆膜腔积液。值得注意的是,尽管两组患者发病初期甘油三酯、葡萄糖水平尚差异无统计学意义,但AKI组患者TyG明显高于对照组[(10.77±1.35)vs.(10.30±1.80),P=0.025]。见表 1。
| 指标 | AKI组(n=79) | 对照组(n=179) | 统计值 | P值 |
| 男性(例,%) | 59(74.68) | 105(58.66) | 6.077 | 0.014 |
| 年龄(岁)a | 61.78± 17.71 | 47.55± 16.65 | -6.205 | < 0.001 |
| 既往史(例,%) | ||||
| 糖尿病 | 22(27.85) | 55(30.73) | 0.217 | 0.641 |
| 高脂血症 | 20(25.31) | 42(23.46) | 0.088 | 0.767 |
| 胆石症 | 13(16.46) | 30(16.76) | 2.871 | 0.090 |
| 高血压 | 45(56.96) | 45(25.14) | 17.898 | < 0.001 |
| 冠心病 | 10(12.66) | 8(4.47) | 4.410 | 0.036 |
| 胰腺炎病因(例,%) | ||||
| 胆源性 | 29(36.71) | 47(26.26) | 2.881 | 0.090 |
| 高脂血症 | 32(40.51) | 48(26.82) | 5.132 | 0.023 |
| 酒精性 | 2(2.53) | 13(7.26) | 1.889 | 0.169 |
| 入院生命体征 a | ||||
| T(℃) | 37.05± 0.87 | 36.68± 3.38 | -0.928 | 0.354 |
| HR(次/分) | 85.99± 21.49 | 78.48± 22.85 | -2.306 | 0.022 |
| SBP(mmHg) | 129.69± 20.97 | 130.39± 19.38 | 0.238 | 0.812 |
| DBP(mmHg) | 77.52± 12.55 | 77.02± 11.99 | -0.284 | 0.777 |
| 血气分析 | ||||
| PaO2(mmHg)b | 79.35(64.23, 105.00) | 81.30(72.80, 100.95) | -0.608 | 0.544 |
| PaCO2(mmHg)b | 31.00(26.78, 38.00) | 32.00(27.50, 37.30) | -0.128 | 0.898 |
| SaO2(%)a | 95.81± 4.12 | 96.57± 2.17 | 0.965 | 0.340 |
| 氧合指数OI b | 354.05(270.12, 424.76) | 372.60(292.00, 420.00) | -0.454 | 0.650 |
| 血常规 | ||||
| WBC(× 109/L)a | 11.85± 6.07 | 11.27± 4.66 | -0.752 | 0.453 |
| NEUT(× 109/L)a | 9.45± 5.62 | 8.93± 4.67 | -0.765 | 0.445 |
| PLT(× 109/L)a | 205.56± 93.20 | 对照组(n=179) | 1.845 | 0.066 |
| HGB(g/L)a | 137.21± 30.14 | 228.13± 86.50 | 1.856 | 0.065 |
| LYM(× 109/L)a | 1.42± 0.91 | 146.21± 37.02 | 0.772 | 0.441 |
| NLRb | 11.08(3.00, 21.30) | 1.58± 1.12 | -2.043 | 0.041 |
| PLRb | 174.18(105.68, 259.44) | 5.77(3.14, 10.66) | -0.665 | 0.506 |
| 血生化 | ||||
| ALT(U/L)b | 26.00(15.00, 82.00) | 154.83(113.13, 236.61) | -1.65 | 0.099 |
| AST(U/L)b | 29.00(19.00, 100.00) | 35.00(20.00, 82.25) | -0.226 | 0.821 |
| GGT(U/L)b | 176.50(115.95, 277.25) | 29.50(18.00, 66.25) | -0.334 | 0.738 |
| LDH(U/L)b | 199.00(127.00, 293.00) | 178.00(82.00, 256.00) | -1.831 | 0.067 |
| ALP(U/L)b | 84.00(63.00, 128.50) | 162.00(61.50, 261.25) | -2.170 | 0.030 |
| Ca(mmol/L)a | 2.13± 0.32 | 93.00(74.00, 129.00) | 0.460 | 0.646 |
| 基线Cr(µmol/L)b | 74.15(61.49, 86.82) | 2.15± 0.24 | -0.341 | 0.733 |
| 基线Bun(mmol/L)b | 6.25(4.33, 10.31) | 74.00(63.75, 85.25) | -1.334 | 0.186 |
| TBIL(µmol/L)b | 19.30(11.00, 31.90) | 5.71(3.50, 6.13) | -2.732 | 0.006 |
| DBIL(µmol/L)b | 6.80(4.28, 12.55) | 12.95(8.55, 26.65) | -2.971 | 0.003 |
| ALB(g/L)a | 39.38± 5.81 | 4.85(2.15, 10.33) | 3.898 | < 0.001 |
| TG(mmol/L)b | 4.02(1.28, 4.67) | 43.07± 7.46 | -1.370 | 0.171 |
| LDL-C(mmol/L)b | 1.50(1.04, 2.42) | 3.41(1.43, 13.84) | -0.042 | 0.966 |
| HDL-C(mmol/L)b | 2.02(1.54, 2.83) | 1.45(1.02, 2.73) | -1.77 | 0.077 |
| 血糖(mmol/L)b | 8.73(7.20, 11.84) | 2.37(1.68, 3.25) | -1.697 | 0.090 |
| 血钾(mmol/L)b | 4.02(3.63, 4.45) | 8.16(5.73, 12.02) | -1.192 | 0.233 |
| 淀粉酶(U/L)b | 448.50(143.50, 1150.25) | 3.95(3.70, 4.23) | -1.495 | 0.135 |
| 脂肪酶(U/L)b | 424.80(172.70, 2 500.30) | 342.00(89.00, 874.00) | -1.157 | 0.247 |
| TyGa | 10.77± 1.35 | 378.00(164.80, 919.85) | -2.254 | 0.025 |
| 尿淀粉酶(U/L)b | 1 792.00(529.75, 3 662.0) | 10.30± 1.80 | -1.053 | 0.293 |
| 炎症指标 | ||||
| CRP(mg/L)b | 80.42(17.98, 142.17) | 1 190.0(367.00, 4 530.00) | -0.880 | 0.379 |
| PCT(ng/mL)b | 2.38(0.31, 16.06) | 45.00(9.01, 134.12) | -3.576 | < 0.001 |
| 补液量(mL/d)a | 3 021.08± 1 282.34 | 0.48(0.13, 0.88) | -0.112 | 0.911 |
| 并发症(例,%) | ||||
| ARDS | 17(21.52) | 2 996.15± 930.07 | 7.777 | < 0.001 |
| 胸腹水 | 21(26.58) | 16(8.94) | 15.092 | < 0.001 |
| 临床评分 b | ||||
| CTSI评分 | 3.0(1.0, 4.0) | 15(8.38) | -0.300 | 0.764 |
| Ranson评分 | 3.0(2.0, 4.0) | 2.0(2.0, 4.0) | -3.684 | < 0.001 |
| APACHE Ⅱ评分 | 8.0(2.0, 10.0) | 2.0(1.0, 3.0) | -4.153 | < 0.001 |
| BISAP评分 | 3.0(1.0, 4.0) | 2.0(0.0, 6.0) | -6.330 | < 0.001 |
| 注:T为体温,HR为心率,SBP为收缩压,DBP为舒张压,PaO2为动脉血氧分压,PaCO2为动脉血二氧化碳分压,SaO2为动脉血氧饱和度,OI为氧合指数,WBC为白细胞计数,NEUT为中性粒细胞计数,PLT为血小板计数,HGB为血红蛋白,NLR为中性粒细胞/淋巴细胞,PLR为血小板/淋巴细胞,ALT为丙氨酸氨基转移酶,AST为天门冬氨酸氨基转移酶,GGT为γ-谷氨酰转移酶,LDH为乳酸脱氢酶,ALP为碱性磷酸酶,TBIL为总胆红素,DBIL为结合胆红素,ALB为白蛋白,BUN为血尿素氮,CRE为肌酐,TG为甘油三酯,HDL为高密度脂蛋白胆固醇,LDL为低密度脂蛋白胆固醇,TyG为甘油三酯葡萄糖指数ln(TG×Glu/2),CRP为C反应蛋白,PCT为降钙素原,ARDS为急性呼吸窘迫综合征,APACHEⅡ为急性生理学与慢性健康状况Ⅱ评分,BISAP评分为急性胰腺炎床旁急性胰腺炎严重度指数评分,CTSI评分为CT严重度指数评分;a为x±s,b为M(Q1, Q3) | ||||
以是否发生AKI为因变量(赋值:AKI=1,无AKI=0),将两组间对比差异有统计学意义的指标临床筛选后进行单因素Logistic回归分析,结果发现性别、年龄、高血压病史、NLR、PCT、TyG、白蛋白水平以及是否发生ARDS和出现胸腹水与AP患者远期AKI发生相关。将上述因素进一步进行多因素Logistic回归分析(年龄、NLR、白蛋白、PCT、TyG为连续变量,赋值为实测值,性别、高血压病史、是否发生ARDS、是否出现胸腹水为二分类变量),结果显示,年龄(OR=1.071,95%CI: 1.020~1.125,P=0.006)、TyG升高(OR=2.632,95%CI: 1.423~4.866,P=0.002)以及PCT水平升高(OR=1.275,95%CI: 1.067~1.524,P=0.008)为AP患者并发AKI的危险因素。见表 2。
| 变量 | 单因素分析 | 多因素分析 | ||||||
| OR | 95%CI | P值 | B | OR | 95%CI | P值 | ||
| 性别 | 2.079 | 1.155~3.743 | 0.015 | |||||
| 年龄 | 1.047 | 1.030~1.065 | < 0.001 | 0.069 | 1.071 | 1.020~1.125 | 0.006 | |
| 心率 | 1.016 | 1.002~1.030 | 0.025 | |||||
| 高血压病 | 4.020 | 2.058~7.853 | < 0.001 | |||||
| NLR | 1.055 | 1.021~1.091 | 0.002 | |||||
| 直接胆红素 | 1.005 | 0.999~1.010 | 0.111 | |||||
| ALP | 1.000 | 1.000~1.001 | 0.351 | |||||
| 白蛋白 | 0.923 | 0.884~0.963 | < 0.001 | |||||
| PCT | 1.255 | 1.071~1.469 | 0.005 | 0.243 | 1.275 | 1.067~1.524 | 0.008 | |
| TyG | 1.188 | 1.004~1.406 | 0.045 | 0.968 | 2.632 | 1.423~4.866 | 0.002 | |
| ARDS | 2.793 | 1.329~5.870 | 0.007 | |||||
| 胸腹水 | 4.100 | 1.978~8.497 | < 0.001 | |||||
| Ranson评分 | 1.643 | 1.278~2.101 | < 0.001 | |||||
| APACHE Ⅱ | 1.229 | 1.123~1.345 | < 0.001 | |||||
| BISAP评分 | 1.550 | 1.191~2.018 | < 0.001 | |||||
| 注:NLR为中性粒细胞/淋巴细胞,ALP为碱性磷酸酶,APACHE Ⅱ为急性生理学与慢性健康状况Ⅱ评分,BISAP评分为急性胰腺炎床旁急性胰腺炎严重度指数评分 | ||||||||
根据上述危险因素,建立预测AP患者并发AKI风险评估模型:Logistic(AKI/AP)= -16.697+0.069×年龄+0.968×TyG+0.243×PCT。进一步对该模型进行Hosmer-Lemeshow检验,结果显示,提示该预测模型拟合良好。
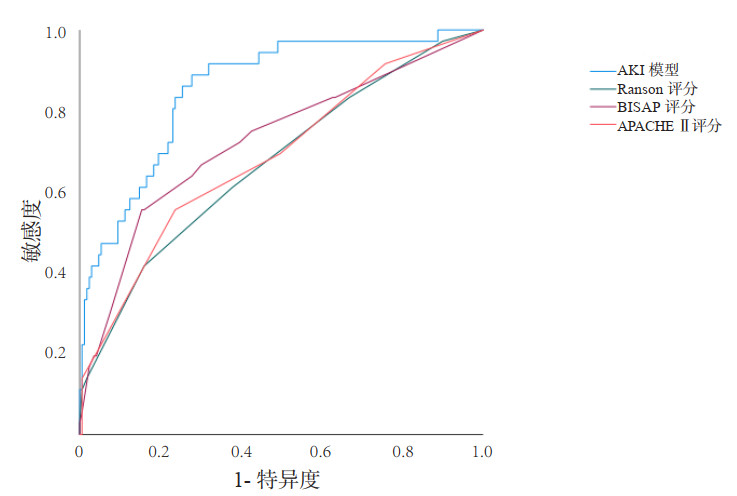
2.3 早期预警模型预测AP并发AKI的诊断价值分析本研究建立的AP并发AKI早期预警模型的诊断敏感度为79.75%(63/79),特异度为96.65%(173/179),阳性预测值为91.30%(63/69),阴性预测值为91.53%(173/189),诊断准确率为91.47%(236/258)(表 4),AUC=0.856(95%CI: 0.790~ 0.922)(图 1)。
| 实际观测 | 模型预测 | 合计 | |
| 有 | 无 | ||
| 有 | 63 | 16 | 79 |
| 无 | 6 | 173 | 179 |
| 合计 | 69 | 189 | 258 |
|
| 图 1 预警模型、Ranson评分、BISAP评分、APACHE Ⅱ评分对AP并发AKI的预测ROC曲线 Fig 1 ROC curve of early warning model, Ranson score, BISAP score and APACHE Ⅱ score for predicting acute pancreatitis complicated with AKI |
|
|
为了进一步评价预警模型的诊断价值,将预警模型的AUC与Ranson评分、BISAP评分、APACHE Ⅱ评分进行了对比,结果发现预警模型在AP中预测AKI的能力优于其他三个评分系统(AUC:0.856 vs. 0.691 vs. 0.745 vs. 0.705,P=0.041)。见图 1、表 5。
| 变量 | AUC | 95%CI | P值 |
| 预警模型 | 0.856 | 0.790~0.922 | < 0.001 |
| Ranson评分 | 0.691 | 0.590~0.672 | 0.001 |
| BISAP评分 | 0.745 | 0.645~0.845 | < 0.001 |
| APACHE Ⅱ评分 | 0.705 | 0.605~0.795 | 0.001 |
| 注:APACHE Ⅱ评分为急性生理学与慢性健康状况Ⅱ评分,BISAP评分为急性胰腺炎床旁急性胰腺炎严重度指数评分 | |||
AKI是AP的常见并发症,发病率约为10%~42%[5],既往研究证实AP并发AKI的发病机制主要包括低血容量导致肾灌注不足、坏死胰腺释放有毒物质(组胺、内毒素等)、剧烈炎症反应、激活肾素导致肾血管阻力增加以及腹内压升高等[6]。而AP患者一旦发生AKI,将严重影响患者的预后,即使在给予积极的肾脏替代治疗的情况下,病死率仍超过50%[7],因此早期预警AP患者并发AKI对于改善患者预后具有极其重要的意义。
目前临床上常用的胰腺炎病情评估系统,如APACHEⅡ评分、Ranson评分、CTSI评分等虽然具有预测AP并发器官功能障碍的作用[8-10],然而这些评分系统并不能准确预测特定器官的功能障碍(如肾脏),更重要的是,这些评分需要在疾病过程中不定期收集复杂的临床信息,部分信息在疾病早期无法获得,因此不适用于AKI早期风险的评估与临床应用[11]。近年来,越来越多的研究开始关注AP并发AKI的危险因素。Yang等[12]的研究发现CRP、腹内压和血清胱抑素C是AP患者发生AKI的独立危险因素,并由此建立起了新的风险评分模型。Wu等[13]则通过多因素logistic回归分析发现,年龄、总胆红素、种族、APTT、机械通气、休克及使用血管活性药物为AP并发AKI的独立危险因素,该预测模型诊断AKI的AUC为0.795,优于BISAP评分及Ranson评分。但这些研究纳入的研究对象大多已进入重症胰腺炎多脏器功能受损阶段,甚至使用了机械通气和血管活性药物,因此对于AP并发AKI的早期预测价值有限,也就无法实现更早干预的临床目标。
近来的研究发现糖脂代谢紊乱和由此引发的胰岛素抵抗(insulin resistance, IR)可能是导致AKI新的发病机制[14]。IR可能通过刺激交感神经,上调肾素-血管紧张素系统活性,使肾小球毛细血管压力升高而导致肾脏损伤的发生,此外,可能还与肾脏细胞代谢、系膜增生、肾脏肥厚及内皮细胞增加有关[14]。目前临床上诊断IR的“金标准”是高胰岛素-正葡萄糖钳夹试验。但该方法的临床应用受到时间长、成本高、侵入性等因素的限制。TyG指数具有简单、方便、稳定性高等特点,可以作为识别IR的替代指标之一[15],因此TyG有可能成为AKI新的指标[16]。有研究发现,在2型糖尿病患者中,TyG的升高与患者肾功能恶化相关,以8.88作为截断值诊断AKI的敏感度可以高达94.9%[17]。而在另一项研究中也证实TyG与高尿酸血症、高LDL-c等是糖尿病患者冠脉造影术后发生AKI的独立危险因素,基于上述指标建立的AKI预测模型AUC为0.811,预测价值良好[18]。上述研究都证实糖脂代谢紊乱及因此引发的胰岛素抵抗可能参与了肾功能受损的病理生理过程。而AP时患者胰腺内分泌功能受损,往往出现高血糖、高脂血症、高胰岛素血症等胰岛素抵抗的表现,因此有研究证实,作为胰岛素抵抗指标的TyG与胰腺炎严重程度正相关[19-20]。本研究发现TyG升高是AP并发AKI的独立危险因素,在进行年龄校正后,TyG升高的患者发生AKI的风险增加1.6倍。
PCT是一种由甲状腺C细胞分泌的糖蛋白,在健康人群血清中其呈低水平表达,当机体受到感染时,血清中PCT被大量释放入血,并呈高水平表达,其可在一定程度上反映机体炎症反应严重程度。既往研究表明在AP患者中,PCT水平也被证实与胰腺病变程度呈正相关,在早期即可反映胰腺的水肿和渗出情况[21]。如果AP患者血清PCT水平大于1 μg/L,其发生感染性坏死的概率会明显增加,因此PCT已经成为AP重要的预后指标之一[22]。除了提示炎症反应的严重程度外,近年来的研究进一步发现PCT水平与炎症反应导致的AKI相关,可以预测严重感染时肾损伤的发生和恢复[23-24]。而陈美颖等[8]进行的Meta分析进一步证实PCT不仅是AP病情严重程度的评价指标,同时也是并发AKI的危险因素之一。本研究结果表明发病早期PCT水平升高与远期发生AKI相关,PCT水平升高是AP发生AKI的独立危险因素。
本研究基于TyG和PCT建立了AP并发AKI的预测模型,并进一步证实该预测模型具有良好的诊断价值,且优于Ranson评分、APACHEⅡ评分及BISAP评分等传统胰腺炎评分系统。更重要的是,本预测模型所包含的临床指标(血糖、血脂、PCT)均可在患者首次就诊后4~6 h内获得,因此能够实现早期预警AP并发AKI的目的,从而为临床提供更多的预后信息和早期干预依据,最终改善患者预后。
本研究基于单中心数据获得上述结论,有一定的局限性,未来需要在更广泛的人群中进行验证。此外,本研究是在患者补液、抗感染及抑制胰腺分泌等胰腺炎其他治疗充分基础上建立起来的模型,而在实际临床工作中,AP并发AKI受到临床治疗的影响较大,因此需要综合全面评估患者的风险。
利益冲突 所有作者声明无利益冲突
作者贡献声明 迟骋:数据分析、论文撰写;马勇,王春雨:数据收集及整理;宋小静:统计学分析;朱继红:研究设计、论文修改
| [1] | Thavamani A, Umapathi KK, Sankararaman S. Prevalence and impact of acute kidney injury in hospitalized pediatric patients with acute pancreatitis[J]. Pediatr Nephrol, 2021, 36(11): 3785-3788. DOI:10.1007/s00467-021-05106-8 |
| [2] | Wajda J, Dumnicka P, Maraj M, et al. Potential prognostic markers of acute kidney injury in the early phase of acute pancreatitis[J]. Int J Mol Sci, 2019, 20(15): 3714. DOI:10.3390/ijms20153714 |
| [3] | 中华医学会消化病学分会胰腺疾病学组, 中华胰腺病杂志编辑委员会, 中华消化杂志编辑委员会. 中国急性胰腺炎诊治指南(2019年, 沈阳)[J]. 中华消化杂志, 2019, 39(11): 721-730. DOI:10.3760/cma.j.issn.0254-1432.2019.11.001 |
| [4] | 国家慢性肾病临床医学研究中心, 中国医师协会肾脏内科医师分会, 中国急性肾损伤临床实践指南专家组. 中国急性肾损伤临床实践指南[J]. 中华医学杂志, 2023, 103(42): 3332-3366. DOI:10.3760/cma.j.cn112137-20230802-00133 |
| [5] | Nassar TI, Qunibi WY. AKI associated with acute pancreatitis[J]. Clin J Am Soc Nephrol, 2019, 14(7): 1106-1115. DOI:10.2215/CJN.13191118 |
| [6] | Scurt FG, Bose K, Canbay A, et al. Acute kidney injury following acute pancreatitis (AP-AKI): Definition, Pathophysiology, Diagnosis and Therapy[J]. Z Gastroenterol, 2020, 58(12): 1241-1266. DOI:10.1055/a-1255-3413 |
| [7] | Nassar TI, Qunibi WY. AKI associated with acute pancreatitis[J]. Clin J Am Soc Nephrol, 2019, 14(7): 1106-1115. DOI:10.2215/CJN.13191118 |
| [8] | 陈美颖, 陈木欣, 王明欣, 等. 重症急性胰腺炎患者并发急性肾损伤危险因素的Meta分析[J]. 中国全科医学, 2022, 25(30): 3834-3842. DOI:10.12114/j.issn.1007-9572.2022.0452 |
| [9] | Coluoglu I, Coluoglu E, Binicier HC, et al. The role of the BISAP score in predicting acute pancreatitis severity according to the revised Atlanta classification: a single tertiary care unit experience from Turkey[J]. Acta Gastroenterol Belg, 2021, 84(4): 571-576. DOI:10.51821/84.4.007 |
| [10] | Teng TZJ, Tan JKT, Baey S, et al. Sequential organ failure assessment score is superior to other prognostic indices in acute pancreatitis[J]. World J Crit Care Med, 2021, 10(6): 355-368. DOI:10.5492/wjccm.v10.i6.355 |
| [11] | Chen X, Jin M, Li Y, et al. Calcium and pH value might predict persistent renal failure in acute pancreatitis in the early phase[J]. Curr Med Res Opin, 2022, 38(4): 535-540. DOI:10.1080/03007995.2022.2038486 |
| [12] | Yang DL, Zhao L, Kang J, et al. Development and validation of a predictive model for acute kidney injury in patients with moderately severe and severe acute pancreatitis[J]. Clin Exp Nephrol, 2022, 26(8): 770-787. DOI:10.1007/s10157-022-02219-8 |
| [13] | Wu SM, Zhou Q, Cai Y, et al. Development and validation of a prediction model for the early occurrence of acute kidney injury in patients with acute pancreatitis[J]. Ren Fail, 2023, 45(1): 2194436. DOI:10.1080/0886022x.2023.2194436 |
| [14] | Sims EK, Carr ALJ, Oram RA, et al. 100 years of insulin: celebrating the past, present and future of diabetes therapy[J]. Nat Med, 2021, 27(7): 1154-1164. DOI:10.1038/s41591-021-01418-2 |
| [15] | Sánchez-García A, Rodríguez-Gutiérrez R, Mancillas-Adame L, et al. Diagnostic accuracy of the triglyceride and glucose index for insulin resistance: a systematic review[J]. Int J Endocrinol, 2020, 2020: 4678526. DOI:10.1155/2020/4678526 |
| [16] | Park HM, Lee HS, Lee YJ, et al. The triglyceride-glucose index is a more powerful surrogate marker for predicting the prevalence and incidence of type 2 diabetes mellitus than the homeostatic model assessment of insulin resistance[J]. Diabetes Res Clin Pract, 2021, 180: 109042. DOI:10.1016/j.diabres.2021.109042 |
| [17] | Qin YH, Tang HX, Yan GL, et al. A high triglyceride-glucose index is associated with contrast-induced acute kidney injury in Chinese patients with type 2 diabetes mellitus[J]. Front Endocrinol, 2021, 11: 522883. DOI:10.3389/fendo.2020.522883 |
| [18] | Hu Y, Wang X, Xiao S, et al. A clinical nomogram based on the triglyceride-glucose index to predict contrast-induced acute kidney injury after percutaneous intervention in patients with acute coronary syndrome with diabetes mellitus[J]. Cardiovasc Ther, 2022, 2022: 5443880. DOI:10.1155/2022/5443880 |
| [19] | 陈旭, 马佳丽, 周玉玲, 等. 甘油三酯-葡萄糖指数对急性胰腺炎严重程度的早期预测价值[J]. 中日友好医院学报, 2021, 35(5): 280-283. DOI:10.3969/j.issn.1001-0025.2021.05.006 |
| [20] | Park JM, Shin SP, Cho SK, et al. Triglyceride and glucose (TyG) index is an effective biomarker to identify severe acute pancreatitis[J]. Pancreatology, 2020, 20(8): 1587-1591. DOI:10.1016/j.pan.2020.09.018 |
| [21] | Paliwal A, Nawal CL, Meena PD, et al. A study of procalcitonin as an early predictor of severity in acute pancreatitis[J]. J Assoc Physicians India, 2022, 70(4): 11-12. |
| [22] | 刘华柱, 张欢, 杨建波. C反应蛋白、降钙素原及铁蛋白水平在急性胰腺炎患者中的变化及意义[J]. 国际检验医学杂志, 2021, 42(17): 2128-2131. DOI:10.3969/j.issn.1673-4130.2021.17.018 |
| [23] | Kan WC, Huang YT, Wu VC, et al. Predictive ability of procalcitonin for acute kidney injury: a narrative review focusing on the interference of infection[J]. Int J Mol Sci, 2021, 22(13): 6903. DOI:10.3390/ijms22136903 |
| [24] | Fu G, Zhan HC, Li HL, et al. Association between procalcitonin and acute kidney injury in patients with bacterial septic shock[J]. Blood Purif, 2021, 50(6): 790-799. DOI:10.1159/000512351 |
 2024, Vol. 33
2024, Vol. 33




