2. 浙江大学医学院附属妇产科医院产科,杭州 310006;
3. 浙江大学医学院附属妇产科医院放射科,杭州 310006
产后出血是孕产妇死亡的最常见原因,可分为发生在分娩24 h内的产后出血(primary PPH, pPPH)和分娩24 h后的晚期产后出血(secondary PPH, sPPH)。晚期产后出血病因多样、临床表现各异,成功治疗的关键在于早期识别病因并对因治疗。子宫血管异常是造成sPPH的罕见原因,包括子宫动静脉畸形(uterine arteriovenous malformation,UAVM)和子宫动脉假性动脉瘤(uterine artery pseudoaneurysm,UAP),缺乏对临床特征、疾病转归的系统研究,若延误诊治易造成失血性休克等产褥期严重并发症。本文回顾性分析浙江大学医学院附属妇产科医院近10年子宫血管异常所致晚期产后出血案例,探讨分娩后发生子宫血管异常的临床特征及其危险因素,以提高临床医生对少见病因所致sPPH的诊治和处理能力。本研究经浙江大学医学院附属妇产科医院伦理委员会的批准(伦理编号:IRB-20230270-R)。
1 资料与方法 1.1 一般资料选择2013年1月至2023年12月浙江大学医学院附属妇产科医院确诊的子宫动静脉瘘或假性动脉瘤导致晚期产后出血患者25例。根据出血量分为无大出血(≤500 mL)和大出血(> 500 mL)两组进行观察。
1.2 纳入及排除标准纳入标准:①妊娠≥28周分娩后24 h至产后12周内发生的生殖道大量出血;②经阴道多普勒超声(transvaginal doppler ultrasound,TVDU)和数字减影血管造影(digital subtraction angiography,DSA)检查诊断为UAVM或UAP;③在医院信息系统(hospital information system,HIS)中有完整病史资料。患者的超声及造影分别由一位有经验的超声科和放射科医生复查和核实。排除标准:影像学资料不完整、图像质量不佳;在HIS中病史不完整;先天性或肿瘤性血管异常。
1.3 观察项目收集患者的年龄、身高、体重、孕次、产次、既往宫腔操作史、末次分娩孕周、分娩方式、有无妊娠期合并症及并发症、分娩时胎盘娩出情况、有无产后出血及宫腔填塞、血管异常类型、是否合并妊娠物残留(retained products of conception,RPOC)和治疗方式。记录分娩后48~72 h及再次入院时血红蛋白(hemoglobin,Hb)、血清人绒毛膜促性腺激素(human chorionic gonadotropin,β-hCG)、血管畸形病灶最大直径、病灶体积、血管阻力指数(resistance index,RI)和治疗方式,进行表格化。
1.4 统计学方法采用SPSS 20.0统计软件进行统计学分析。符合正态分布的计量资料用均值±标准差(x±s)表示,组间比较采用独立样本t检验;不符合正态分布的计量资料使用中位数[M(Q1,Q3)]表示,组间比较采用秩和检验。计数资料采用例数和百分数描述,采用χ2检验。采用差异有统计学意义的高危因素及临床上有相关性的参数行二分类Logistic回归分析评估危险因素对于血管异常导致晚期产后大出血的预测价值,同时使用受试者工作特征曲线(ROC)确定最佳临界值。以P<0.05为差异有统计学意义。
2 结果25例晚期产后出血患者均经DSA确诊为子宫血管异常,其中UAVM 17例,UAP 8例,合并产褥感染者2例,合并妊娠物残留者8例。患者年龄为(30.84±3.24)岁,BMI为(21.84±2.09)kg/m2,分娩孕周中位数为孕38.0周,9例经阴道分娩,16例经剖宫产分娩。出现临床症状的中位时间为产后23.0 (15.5, 37.5) d;所有患者均以阴道流血为主要表现,包括12例突发大量阴道出血和13例反复少量阴道流血者,其中3例伴随腹痛。22例产妇行子宫动脉栓塞术(uterine artery embolization,UAE),其中1例行单侧UAE,21例行双侧UAE,3例患者期待治疗,所有患者均预后良好,随访无并发症发生。根据晚期产后出血量,是否发生大出血的患者在年龄、BMI、孕产次、人工流产和宫腔镜手术次数、分娩孕周、发病到分娩时间间隔、末次妊娠情况(罹患妊娠期高血压疾病、胎盘黏连/植入、人工剥离胎盘、宫腔填塞)、分娩后血红蛋白水平、合并妊娠物残留、病灶最大直径、RI、β-HCG阳性例数方面的差异无统计学意义(P>0.05)。大出血组的异常血管病灶平均体积(36.87±20.37) cm3,非大出血组的异常血管病灶平均体积为(16.92±13.01) cm3,两组相比较,差异有统计学意义(P<0.05)。此外,大出血组发病时的血红蛋白和血小板计数也显著低于非大出血组,差异有统计学意义(P<0.05)。
| 因素 | 总体(n=25) | 非大出血组(n=17) | 大出血组(n=8) | P值 |
| 年龄(岁)a | 30.84±3.24 | 30.76±3.49 | 31.00±2.83 | 0.870 |
| BMI(kg/m2)a | 21.84±2.09 | 21.78±2.31 | 21.99±1.65 | 0.818 |
| 孕次(次)b | 2(1, 3.5) | 2(1, 4) | 2(1.25, 3) | 0.932 |
| 产次(次)b | 1(1, 2) | 1(1, 2) | 1(1, 2) | 1.000 |
| 宫腔镜(次)b | 0(0, 1) | 0(0, 1) | 0(0, 0.75) | 0.315 |
| 人工流产(次)b | 0(0, 2) | 1(0, 2) | 0(0, 2) | 0.628 |
| 血管畸形类型 | 1.000 | |||
| 动静脉瘘 | 17 | 11(64.7) | 6(75) | |
| 假性动脉瘤 | 8 | 6(35.3) | 2(25) | |
| 分娩孕周(周)b | 38.0(35.0, 39.0) | 38.0(35.0, 39.0) | 38.5(34.25, 39.75) | 0.842 |
| 发病到分娩间隔(d)b | 23.0(15.5, 37.5) | 24.0(17.0, 37.0) | 19.5(10.50, 42.0) | 0.588 |
| 本次妊娠情况 | ||||
| 妊娠期高血压疾病(n) | 3 | 2(11.8) | 1(12.5) | 1.000 |
| 胎盘黏连/植入(n) | 2 | 1(5.9) | 1(12.5) | 1.000 |
| 早期产后出血(n) | 9 | 7(41.2) | 2(25) | 0.661 |
| 人工剥离胎盘(n) | 8 | 7(41.2) | 1(12.5) | 0.205 |
| 宫腔填塞(n) | 6 | 4(23.5) | 2(25) | 1.000 |
| 分娩后血红蛋白(g/L)a | 106.16±17.44 | 109.00±15.77 | 100.13±20.34 | 0.243 |
| 合并RPOC | 8 | 7(41.2) | 1(12.5) | 0.205 |
| 异常血管病灶体积(cm3)a | 23.30±18.00 | 16.92±13.01 | 36.87±20.37 | 0.007 |
| 最大直径(cm)a | 3.08±1.32 | 2.95±1.31 | 3.34±1.38 | 0.509 |
| RIa | 0.46±0.13 | 0.47±0.14 | 0.45±0.10 | 0.695 |
| 发病时血红蛋白(g/L)a | 92.84±18.59 | 100.00±15.06 | 77.63±16.66 | 0.003 |
| β-HCG阳性(n) | 7 | 7(41.2) | 0(0) | 0.057 |
| 注:a为x±s,b为M(Q1,Q3) | ||||
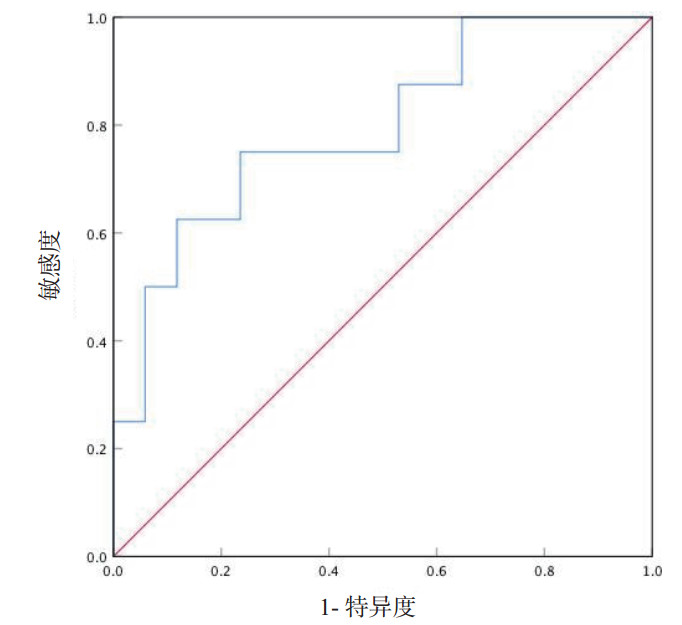
将异常血管病灶体积进行ROC曲线绘制,发现当异常血管病灶体积 > 23.07 cm3时可预测发生晚期产后大出血,曲线下面积(area under the curve,AUC)为0.794(P=0.020),敏感度为75%,特异度为76.5%(图 1)。理论上临床中各类宫腔操作均为导致血管畸形的危险因素,但由于本研究样本量小,故仅纳入异常血管病灶体积和合并妊娠物残留进行多因素Logistic回归分析。结果发现,异常血管病灶体积>23.07 cm3,其发生晚期产后大出血的风险增加23.67倍,差异有统计学意义(P=0.015)。见表 2。
|
| 图 1 血管畸形病灶大小与晚期产后大出血风险的ROC曲线 |
|
|
| 因素 | OR | 95%CI(OR) | P值 |
| 异常血管病灶体积 | 24.67 | 1.880~323.570 | 0.015 |
| 妊娠物残留 | 0.06 | 0.003~1.173 | 0.064 |
子宫动静脉瘘和假性动脉瘤均为晚期产后出血的罕见病因,前者以子宫动脉分支与肌层静脉丛之间的异常交通为特征[1-2],后者则为子宫动脉损伤后血液外渗并被周围组织包裹形成血肿。关于分娩相关子宫血管异常的发生率鲜有报道,有学者随访882例分娩结局发现分娩后UAVM的发生率为0.22%(2/882)[3]。本研究显示分娩后血管异常发生率约为0.2‰,但可能低估实际发生率。各类子宫手术均可造成获得性子宫血管异常,包括宫腔镜、肌瘤剔除、刮宫术、宫内节育器取出、人工剥离胎盘等[4, 5]。本研究纳入的25例患者中,9例阴道分娩,16例剖宫产,9例产后24 h内发生产后出血,8例人工剥离胎盘,6例产后曾行宫腔填塞,1例阴道分娩者因胎盘残留曾行清宫术,可见各类操作均存在损伤产褥期子宫血管的风险。此外,合并感染或妊娠物残留亦可能是造成子宫血管损伤的重要因素[6-7]。临床症状常表现为持续阴道出血、下腹痛和继发性贫血等[8]。本研究病例中阴道出血的表现从间断少量出血到突发大出血。因受累部位动静脉间血管压力梯度差或动脉壁突破性损伤,导致出血模式可能是“开关式”的,严重时可导致重度贫血、晕厥甚至循环失代偿等情况[4]。对大出血的预测可显著降低产妇严重并发症的风险。以往有文献报道子宫动静脉瘘合并妊娠物残留可能具有更高的出血风险[9]。将晚期产后大出血组和非大出血组比较,发现两组间合并妊娠物残留比例差异无统计学意义,提示合并妊娠物残留并未增加子宫血管异常引起的出血风险。
hCG升高是RPOC并发UAVM的独立危险因素[10-11]。本组案例中有3例为辅助生殖技术助孕,虽然缺乏关于辅助生殖技术与子宫血管异常的相关性研究,但辅助生殖助孕时胎盘发育和子宫灌注受到干扰[12],且困难胚胎移植可能导致内膜损伤[3],因此推测辅助生殖技术可能通过子宫血管的结构性重塑从而参与子宫血管异常的发展。通过将晚期产后大出血组和非大出血组间的各相关因素进行比较,发现仅异常血管病灶体积与晚期产后出血量相关,异常血管病灶体积>23.07 cm3,其发生晚期产后大出血的风险增加23.67倍。
子宫血管异常的诊断方法主要包括超声、MRI、CT和数字减影血管造影(digital subtraction angiography,DSA)。彩色多普勒超声是首选的诊断方法,CDFI显示UAVM病灶内血流呈现湍流和多向流动的“五彩镶嵌”图案[13],而UAP则以收缩期血液流入假性动脉瘤内,舒张期血液从瘤腔流出的“阴阳”模式为特征[14]。CT和MRI可显示病变的大小、范围、血管分布及周围组织的受累情况[15]。DSA则是诊断金标准且同时可行UAE治疗。由于一旦将血管异常误诊为RPOC直接进行刮宫术会加重出血[16],因此妊娠物残留是最重要的鉴别诊断。RPOC患者血流从子宫内膜发生并延伸至子宫肌层,而UAVF患者血流主要集中在子宫肌层,且UAVF患者PSV值更高(≥60~70 cm/s)[17-18]。本组案例中有8例为血管异常合并RPOC,均最终通过MRI联合CTA确诊。对于此类患者,若产时有胎盘黏连或植入、hCG升高、近期刮宫病史,结合影像学检查可能更有利于诊断[19]。
治疗应根据患者年龄、出血量、病灶大小、血流动力学及日后生育要求等综合考虑制定方案。虽然文献报道药物(孕激素、促性腺激素释放激素激动剂、甲氨蝶呤、复方激素避孕药等)治疗UAVM成功率较高[20],但在产褥期应用受限。无论何种血管异常类型,若发生危及生命的出血,放置宫内Foley导尿管或宫颈球囊可能有助于短期止血。UAE是产褥期最常用的治疗方法,不仅相对安全微创,避免再次手术,且不增加未来生育力损伤的风险[9, 21-23]。文献报道双侧栓塞较单侧栓塞减少了复发的概率,本组案例多为双侧栓塞,且无一例复发[24]。亦有文献报道保守治疗成功者[25],本案例中2例UAVM和1例UAP保守治疗成功,均为病灶体积小且出血量少者。对于血管畸形合并RPOC时,可优先选择UAE阻断病灶血供,随后根据残留物大小选择清宫或宫腔镜手术精准切除病灶[9]。
利益冲突 所有作者声明无利益冲突
作者贡献声明 阮恒超:研究设计、论文撰写;陈璐:数据收集及整理、统计学分析、论文撰写;周微笑:解释数据、统计指导;钱越:实施超声部分研究;李奎:实施CTA部分研究
| [1] | Salmeri N, Papale M, Montresor C, et al. Uterine arteriovenous malformation (UAVM) as a rare cause of postpartum hemorrhage (PPH): a literature review[J]. Arch Gynecol Obstet, 2022, 306(6): 1873-1884. DOI:10.1007/s00404-022-06498-0 |
| [2] | Cotter T, Arfa A, Moideen P, et al. Arteriovenous malformation of the uterus in a 41-year-old woman presenting as uterine bleeding[J]. Cureus, 2022, 14(3): e23646. DOI:10.7759/cureus.23646 |
| [3] | Yazawa H, Soeda S, Hiraiwa T, et al. Prospective evaluation of the incidence of uterine vascular malformations developing after abortion or delivery[J]. J Minim Invasive Gynecol, 2013, 20(3): 360-367. DOI:10.1016/j.jmig.2012.12.008 |
| [4] | Hong W, Wang BY, Wu ZP, et al. Systematic retrospective analysis of 13 cases of uterine arteriovenous fistula: Pathogeny, diagnosis, treatment and follow-up[J]. J Obstet Gynaecol Res, 2020, 46(7): 1117-1127. DOI:10.1111/jog.14264 |
| [5] | Yang JJ, Xiang Y, Wan XR, et al. Diagnosis and management of uterine arteriovenous fistulas with massive vaginal bleeding[J]. Int J Gynaecol Obstet, 2005, 89(2): 114-119. DOI:10.1016/j.ijgo.2004.11.037 |
| [6] | Yi SW. Extravasating uterine pseudoaneurysm: a rare cause of postpartum haemorrhage[J]. J Obstet Gynaecol, 2017, 37(4): 416-420. DOI:10.1080/01443615.2016.1274292 |
| [7] | Lamrissi A, Mabengui AF, Mourabbih M, et al. Acquired uterine arterio-venous malformation post molar pregnancy suction-curettage: 2 case reports[J]. Int J Surg Case Rep, 2022, 94: 107105. DOI:10.1016/j.ijscr.2022.107105 |
| [8] | Kulshrestha V, Shivhare S, Meena J, et al. Outcome in women undergoing uterine artery embolization for arterio-venous malformation diagnosed post-pregnancy-a retrospective study[J]. Turk J Obstet Gynecol, 2022, 19(2): 111-117. DOI:10.4274/tjod.galenos.2022.34683 |
| [9] | Gao F, Ma XW, Xu YL, et al. Management of acquired uterine arteriovenous malformations associated with retained products of conception[J]. J Vasc Interv Radiol, 2022, 33(5): 547-553. DOI:10.1016/j.jvir.2022.01.004 |
| [10] | Chen HZ, Zhao FM, Liu LJ, et al. Accuracy of flow-void diameters on MR images in diagnosing uterine arteriovenous malformations in patients with pregnancy-related diseases[J]. Sci Rep, 2021, 11(1): 19806. DOI:10.1038/s41598-021-99209-9 |
| [11] | Rampersad F, Narine S, Rampersad D, et al. Uterine arteriovenous malformation mimicking retained products Of conception - treated with embolization[J]. Radiol Case Rep, 2020, 15(11): 2076-2079. DOI:10.1016/j.radcr.2020.08.048 |
| [12] | van Duijn L, Rousian M, Reijnders IF, et al. The influence of frozen-thawed and fresh embryo transfer on utero-placental (vascular) development: the Rotterdam Periconception cohort[J]. Hum Reprod, 2021, 36(8): 2091-2100. DOI:10.1093/humrep/deab070 |
| [13] | Polat P, Suma S, Kantarcý M, et al. Color Doppler US in the evaluation of uterine vascular abnormalities[J]. Radiographics, 2002, 22(1): 47-53. DOI:10.1148/radiographics.22.1.g02ja0947 |
| [14] | Sharma N, Ganesh D, Devi L, et al. Prompt diagnosis and treatment of uterine arcuate artery pseudoaneurysm: a case report and review of literature[J]. J Clin Diagn Res, 2013, 7(10): 2303-2306. DOI:10.7860/JCDR/2013/6063.3506 |
| [15] | Oh CH, Kim Y, Cho BS, et al. Successful transcatheter arterial embolization for massive hemorrhage from acquired uterine arteriovenous malformation which occurred as a complication of hysterectomy: a case report[J]. Medicine, 2021, 100(2): e24052. DOI:10.1097/MD.0000000000024052 |
| [16] | Sharpless KE, Pappas II, Dobrow EM, et al. Severe hemorrhage due to acquired uterine arteriovenous malformation/fistula following first-trimester aspiration abortion: a case report[J]. Case Rep Womens Health, 2022, 34: e00410. DOI:10.1016/j.crwh.2022.e00410 |
| [17] | Gilbert A, Thubert T, Dochez V, et al. Angiographic findings and outcomes after embolization of patients with suspected postabortion uterine arteriovenous fistula[J]. J Gynecol Obstet Hum Reprod, 2021, 50(7): 102033. DOI:10.1016/j.jogoh.2020.102033 |
| [18] | Chatra P. Iatrogenic uterine injury leading to uterine arteriovenous malformation[J]. Radiol Case Rep, 2021, 16(8): 2146-2150. DOI:10.1016/j.radcr.2021.05.014 |
| [19] | Jha S, Singh A. Arteriovenous malformation complicating cesarean scar pregnancy: a rare case of vaginal bleeding managed successfully by uterine artery embolization[J]. J Family Reprod Health, 2021, 15(3): 210-214. DOI:10.18502/jfrh.v15i3.7140 |
| [20] | Rosen A, Chan WV, Matelski J, et al. Medical treatment of uterine arteriovenous malformation: a systematic review and meta-analysis[J]. Fertil Steril, 2021, 116(4): 1107-1116. DOI:10.1016/j.fertnstert.2021.05.095 |
| [21] | Rudaitis V, Maldutytė G. Uterine arteriovenous malformation treated with selective embolisation of uterine arteries: a case report[J]. Acta Med Litu, 2021, 28(1): 153-158. DOI:10.15388/Amed.2021.28.1.17 |
| [22] | Delplanque S, Le Lous M, Proisy M, et al. Fertility, pregnancy, and clinical outcomes after uterine arteriovenous malformation management[J]. J Minim Invasive Gynecol, 2019, 26(1): 153-161. DOI:10.1016/j.jmig.2018.05.001 |
| [23] | Isono W, Tsutsumi R, Wada-Hiraike O, et al. Uterine artery pseudoaneurysm after cesarean section: case report and literature review[J]. J Minim Invasive Gynecol, 2010, 17(6): 687-691. DOI:10.1016/j.jmig.2010.06.004 |
| [24] | Nanjundan P, Rohilla M, Raveendran A, et al. Pseudoaneurysm of uterine artery: a rare cause of secondary postpartum hemorrhage, managed with uterine artery embolisation[J]. J Clin Imaging Sci, 2011, 1: 14. DOI:10.4103/2156-7514.76692 |
| [25] | Thakur M, Strug MR, De Paredes JG, et al. Ultrasonographic technique to differentiate enhanced myometrial vascularity/arteriovenous malformation from retained products of conception[J]. J Ultrasound, 2022, 25(2): 379-386. DOI:10.1007/s40477-021-00574-y |
 2024, Vol. 33
2024, Vol. 33




