2. 江苏大学医学院实验中心,镇江 212013
2. Department of experiment center, School of Medicine Jiangsu University, Zhenjiang 212013, China
百草枯(paraquat,PQ)是一种有机杂环类除草剂,毒性强,致死剂量低。我国每年有大量中毒患者,口服致死率高达90%[1-2]。PQ可经消化道、呼吸道、皮肤吸收而造成多脏器多器官功能衰竭,临床尚无特效治疗手段,社会负担沉重。肺部是其主要靶器官,肺上皮细胞摄取并蓄积PQ,导致肺上皮细胞受损、凋亡及炎性细胞大量浸润,进而引发进行性肺纤维化和呼吸衰竭而死亡[3-4]。目前PQ致肺纤维化的分子机制尚未完全阐明,研究表明,上皮-间质转化(EMT)、炎症反应和氧化应激在PQ致肺纤维化中均发挥重要作用,其中Wnt/β-catenin[5-6]、PI3K/AKT[7]、Notch[8]和TGF-β/Smads[9]等信号通路参与介导EMT进程。此外,微小核糖核酸(miRNAs)亦可参与调控EMT和肺纤维化的发生发展[10-11]。研究发现,PQ诱导的肺纤维化中miRNAs的表达差异显著[12],然而miRNAs在其中发挥的具体调控作用尚未明确。鉴于此,本研究通过体内外实验,探究miRNAs在PQ致肺纤维化中的生物学功能和分子机制,为PQ致肺损伤机制的阐明及干预靶点的选择提供理论基础和实验依据。
1 材料和方法 1.1 实验材料人支气管肺上皮细胞系(16HBE,美国ATCC细胞库);DMEM培养基、胎牛血清(FBS)、0.25%胰酶-EDTA和双抗(100×Penicillin-Streptomycin)(美国Gibco);miR-15a-5p模拟体(mimics)、嘌呤霉素和过表达miR-15a-5p慢病毒(上海吉凯基因科技有限公司);百草枯试剂(美国Sigma);RNeasy总RNA纯化Mini试剂盒(德国QIAGEN);miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)和ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司);HisScriptⅡ QRT SuperMix for qPCR(上海科创达生物医药科技有限公司);荧光素酶检测试剂盒(美国Promega);Wnt3α、α SMA、Vimentin、CollagenⅠ、CK18、Occludin、β-catenin和GAPDH一抗(英国Abcam);山羊抗兔二抗(美国Jackson Immuno Research)。
Thermo 3111型CO2细胞培养箱(美国Thermo);K6600-C全波长酶标仪(北京凯奥科技发展有限公司);A200基因扩增仪(杭州市朗基科学仪器有限公司);LightCycler® 96实时荧光定量PCR仪(瑞士Roche);PowerPac HC Western blot电泳-转膜系统(美国Bio-Rad);Tanon-5200全自动化学发光图像分析系统(上海天能科技有限公司)。
1.2 实验方法 1.2.1 细胞培养16HBE细胞使用DMEM完全培养基(含10%FBS,1%双抗)于CO2细胞培养箱(5%CO2,37℃)中培养。待细胞长至80%左右传代。根据实验目的进行分组处理,NC(normal control)组:正常对照,无特殊处理;PQ组:50 µmol/L的PQ处理细胞72 h;miR-15a-5p组:16HBE转染miR-15a-5p过表达慢病毒,使用1 µg/mL嘌呤霉素筛选构建的稳转株;miR-15a-5p+PQ组:50 µmol/L的PQ处理稳转株细胞72 h。
1.2.2 实时荧光定量PCR(RT-qPCR)使用RNeasy总RNA纯化Mini试剂盒提取各组细胞的总RNA。使用HisScriptⅡ QRT SuperMix for qPCR试剂将总RNA逆转录成cDNA,使用miRNA 1st Strand cDNA Synthesis Kit(by stem-loop)进行miRNA第一链cDNA的合成。在LightCycler® 96 RT-qPCR系统中使用ChamQ Universal SYBR qPCR Master Mix以各组稀释后的cDNA为模板,以GAPDH或U6为内参进行qPCR,分析各组基因Ct值,2-ΔΔCt法计算mRNA相对表达水平。引物由江苏赛索飞生物科技有限公司合成,引物序列见表 1。
| 引物名称 | 引物序列(5’→3’) |
| miR-15a-5p RT primer | GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCACAAA |
| miR-15a-5p Forward primer | CGCGTAGCAGCACATAATGG |
| miR-15a-5p Reverse primer | AGTGCAGGGTCCGAGGTATT |
| U6 RT primer | CGCTTCACGAATTTGCGTGTCAT |
| U6 Forward primer | GCTTCGGCAGCACATATACTAAAAT |
| U6 Reverse primer | CGCTTCACGAATTTGCGTGTCAT |
| β-catenin Forward primer | GGCTACTCAAGCTGATTTGATGG |
| β-catenin Reverse primer | GATGGTTCAGCCAAACGCTG |
| Collagen I Forward primer | TGGTGCTACTGGTGCTGC |
| Collagen I Reverse primer | CACCCTGGGGACCTTCAGAG |
| Vimentin Forward primer | GGACCAGCTAACCAACGACA |
| Vimentin Reverse primer | AAGGTCAAGACGTGCCAGAG |
| Occludin Forward primer | ACAGACTACACAACTGGCGG |
| Occludin Reverse primer | TTTGTGATGCTCACAGAGGT |
| CK18 Forward primer | CCTTTCTCTCTCCCCGGAC |
| CK18 Reverse primer | GTCGTTCAGGCTTTGCATGG |
| α-SMA Forward primer | CACGATGTACCCTGGGATCG |
| α-SMA Reverse primer | GCCGATCCACACCGAGTATT |
| Wnt3α Forward primer | ATGAACCGCCACAACAACGAGG |
| Wnt3α Reverse primer | GTCCTTGAGGAAGTCACCGATG |
| GAPDH Forward primer | GTCTCCTCTGACTTCAACAGCG |
| GAPDH Reverse primer | ACCACCCTGTTGCTGTAGCCAA |
设计并合成miR-15a-5p mimics(成熟miRNAs模拟物,以双链形式合成,末端加入2个碱基TT悬垂用来模拟生理状态下的miRNAs)及阴性对照无义序列RNA(NC mimics)。将miR-15a-5p mimics或NC mimics与pMIR空载质粒或含靶点的荧光素酶报告基因重组质粒(pMIR-Wnt3α-WT)或含突变靶点的荧光素酶报告基因重组质粒(pMIR-Wnt3α-MT)两两共转染293T细胞,转染24 h后,使用荧光素酶检测试剂盒检测荧光素酶活性,计算相对表达量。
1.2.4 蛋白印迹分析(Western blot,WB)使用RIPA裂解缓冲液制备各组蛋白样本,测定蛋白浓度。根据目的蛋白相对分子质量大小使用适宜浓度SDS-PAGE凝胶进行电泳分离蛋白,经转膜、封闭、一抗孵育和二抗孵育后使用化学发光法进行显影,采用ImageJ软件(1.42q,Way Rasband,National Institutes of Health,USA)分析蛋白条带灰度值。
1.2.5 肺纤维化动物模型实验选用6-8周龄雄性C57BL/6小鼠,经腹腔注射PQ 30mg/kg一次性染毒,对照组给予腹腔注射等量生理盐水。SPF级环境下饲喂,14 d后处死。取适量肺组织,4%多聚甲醛常温固定16 h。制作石蜡切片,苏木精-伊红(HE)染色,观察肺组织结构状况,免疫组织化学染色检测肺组织纤维化标记表达情况。
1.3 统计学方法实验数据采用SPSS 22.0软件和GraphPad Prism 8.0.2软件进行统计分析,正态分布的计量资料以均数±标准差(x±s)表示。两组间数据比较采用独立样本t检验,P < 0.05表示差异具有统计学意义。
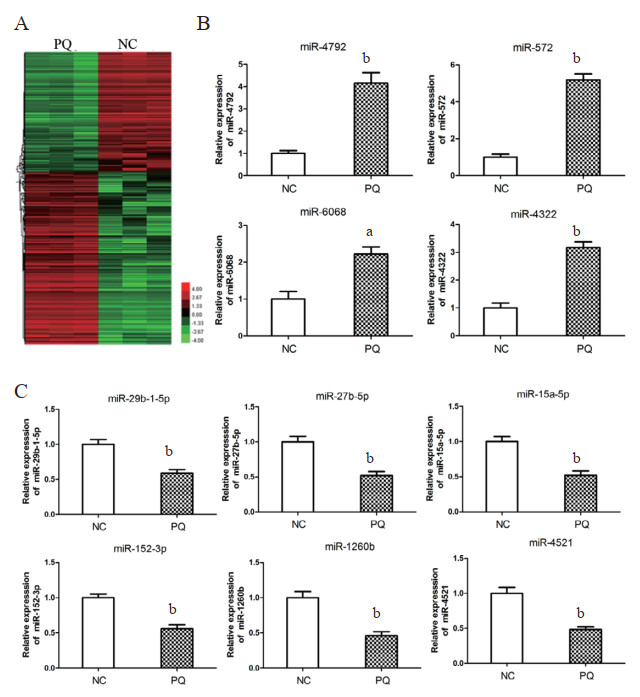
2 结果 2.1 PQ诱导的肺上皮细胞中miRNAs表达情况构建PQ诱导的16HBE肺上皮细胞损伤模型,采用高通量miRNA芯片技术筛选细胞中表达差异明显的miRNAs。运用RT-qPCR技术对芯片筛选结果进行验证,发现10条差异表达的miRNAs。如图 1所示,与NC组相比,其中4条miRNAs(miR-4792、miR-572、miR-6068和miR-4322)显著上调,6条miRNAs(miR-29b-1-5p、miR-27b-5p、miR-15a-5p、miR-152-3p、miR-1260b和miR-4521)显著下调。
|
| A:miRNA芯片检测表达改变的miRNAs;B:表达上调的miRNAs;C:表达下调的miRNAs。aP < 0.05,bP < 0.01 图 1 PQ诱导的人肺上皮细胞中miRNAs表达情况 Fig 1 The miRNAs expression in PQ-induced human lung epithelial cells |
|
|
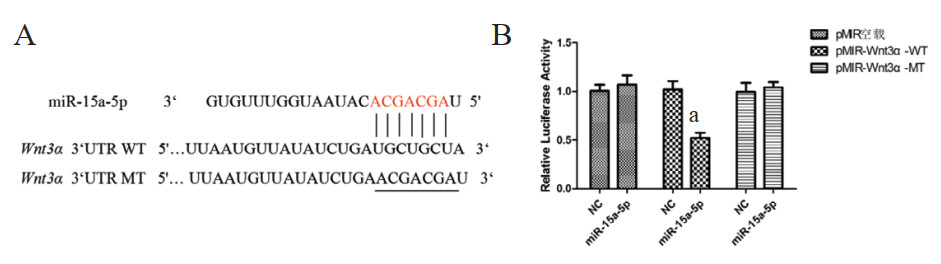
使用miRDB、RNAhybrid和DIANA TOOLS网站进行miR-15a-5p靶基因预测,选择与种子序列完全匹配,与EMT进程相关的基因Wnt3α进行研究。荧光素酶报告基因实验验证miRNA与靶基因之间的调控关系,如图 2所示,与NC组相比,pMIR-Wnt3α-WT型重组质粒与miR-15a-5p mimics共转染293T细胞后,其相对荧光素酶活性显著下降。pMIR-Wnt3α--MT型重组质粒组相对荧光素酶活性差异无统计学意义。表明miR-15a-5p可靶向结合Wnt3α的3’ UTR区域。
|
| A:miR-15a-5p靶基因Wnt3α的结合位点及突变体设计;B:荧光素酶报告基因实验检测报告基因活性。aP < 0.01 图 2 miR-15a-5p靶基因的预测及验证 Fig 2 Prediction and verification of the target genes of miR-15a-5p |
|
|
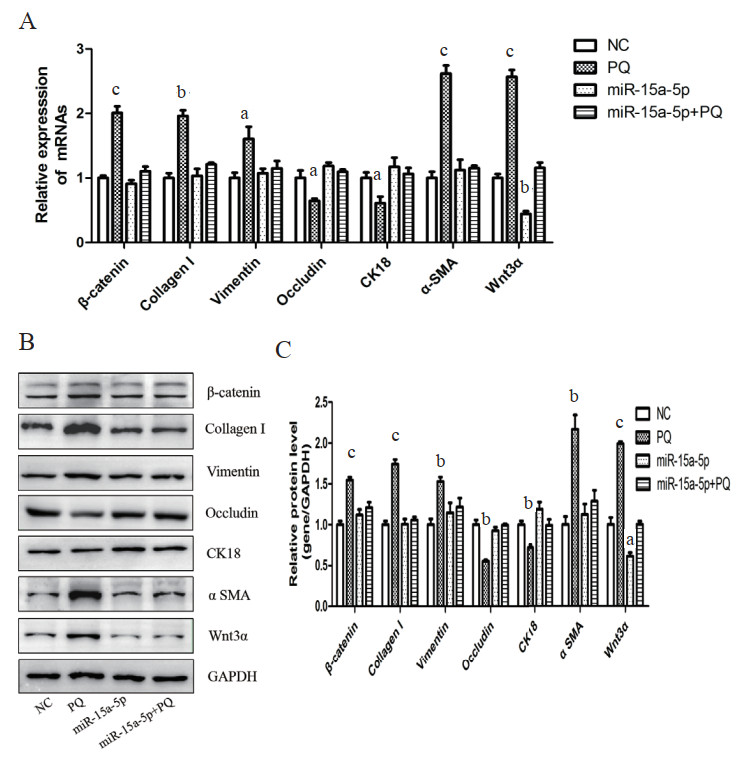
构建miR-15a-5p过表达的16hbe细胞稳转株,探究PQ对其基因表达的作用。采用RT-qPCR检测相关基因mRNA表达水平,如图 3A所示,与NC组相比,PQ可使Wnt通路相关基因Wnt3α和β-catenin、成纤维细胞标记基因Collagen I、Vimentin和α SMA的mRNA水平显著上调,上皮细胞标记基因Occludin和CK18的mRNA水平显著下调,miR-15a-5p组Wnt3α的mRNA水平显著下调,miR-15a-5p+PQ组各基因mRNA水平差异无统计学意义。采用Western blot检测其蛋白表达情况,如图 3B和3C所示,与nc组相比,PQ可使Wnt通路相关基因Wnt3α和β-catenin、纤维化标记基因Collagen I、Vimentin和α SMA的蛋白水平显著上调,上皮细胞标记基因Occludin和CK18的蛋白水平显著下调,miR-15a-5p组Wnt3α蛋白水平显著下调,miR-15a-5p+PQ组各基因蛋白水平差异无统计学意义。表明miR-15a-5p可调控Wnt3α/β-catenin信号通路从而改善PQ诱导的肺上皮细胞EMT转化。
|
| A:RT-qPCR检测mRNA表达情况;B:Western blot检测蛋白表达水平;C:目的条带灰度值分析及统计。aP < 0.05,bP < 0.01,cP < 0.01 图 3 miR-15a-5p对PQ诱导的肺上皮细胞基因表达影响 Fig 3 The effect of miR-15a-5p on gene expression in PQ-induced lung epithelial cells |
|
|
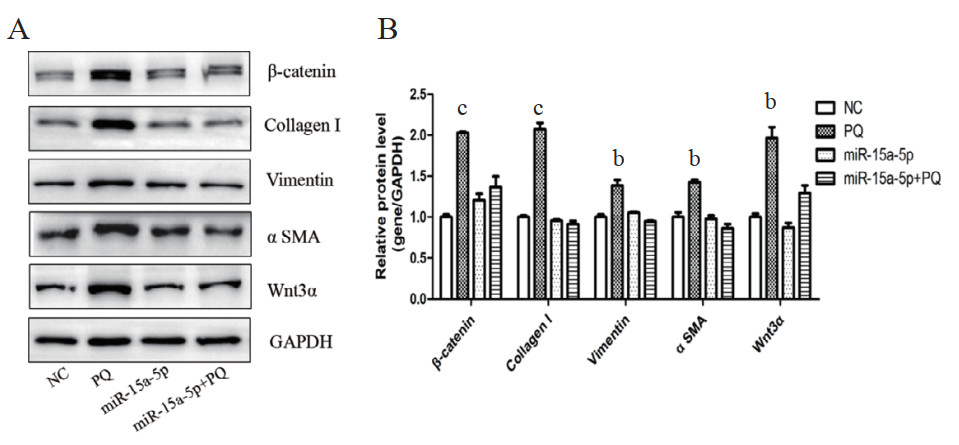
构建PQ诱导的肺纤维化小鼠模型,经气道给予miR-15a-5p过表达慢病毒,验证其对PQ导致的肺纤维化的影响。如图 4所示,与NC组相比,PQ组Wnt通路相关基因Wnt3α和β-catenin、纤维化标记基因Collagen I、Vimentin和α SMA的蛋白水平显著上调,miR-15a-5p组和miR-15a-5p+PQ组各基因蛋白水平差异无统计学意义。表明miR-15a-5p可通过调控Wnt3α/β-catenin信号通路,抑制PQ诱导的EMT进程。
|
| A:Western blot检测相关蛋白表达水平;B:目的条带灰度值分析及统计。bP < 0.01,cP < 0.01 图 4 miR-15a-5p对小鼠肺组织蛋白表达的影响 Fig 4 The effect of miR-15a-5p on protein expression in the lung of mice |
|
|
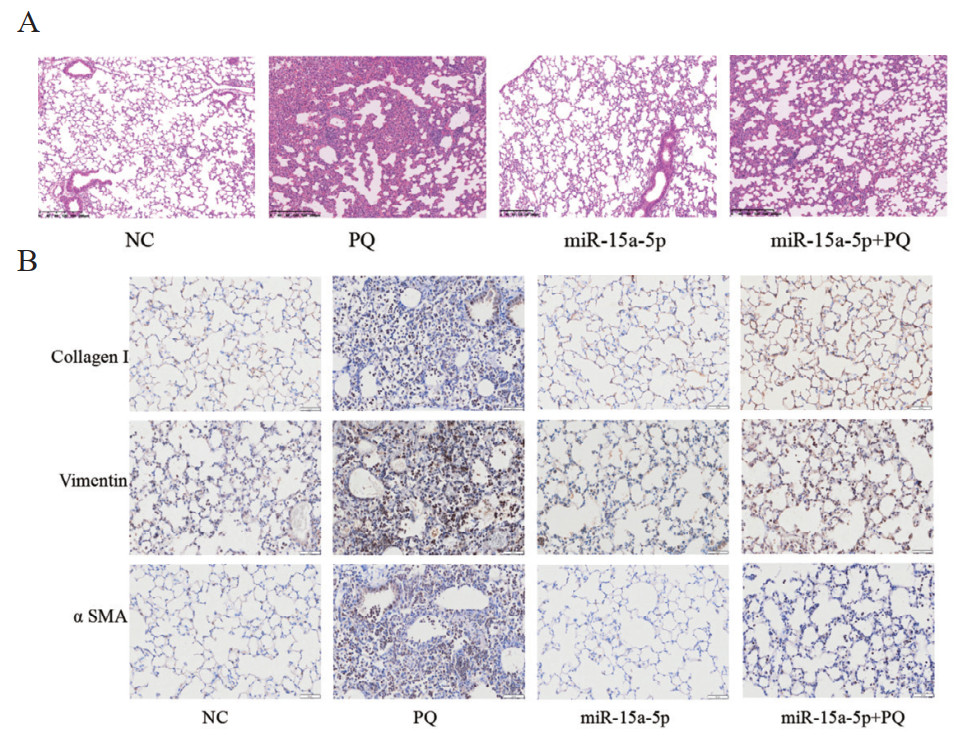
经气道滴注给予肺纤维化小鼠miR-15a-5p过表达慢病毒,采用HE染色和免疫组织化学检测肺损伤情况。如图 5A所示,miR-15a-5p可抑制PQ引起的肺组织结构紊乱、肺泡壁增厚和肺间质纤维化。如图 5B所示,与PQ组相比,miR-15a-5p可使纤维化标记蛋白Collagen I、Vimentin和α SMA表达下降,从而抑制PQ所致的肺纤维化发生发展,促进肺组织修复。
|
| A:HE染色观察小鼠肺组织病理学结构,放大倍数:100x;B:免疫组织化学检测肺组织纤维化标记蛋白的表达情况,放大倍数:×200 图 5 miR-15a-5p对小鼠肺损伤的影响 Fig 5 The effect of miR-15a-5p on the lung injury in mice |
|
|
PQ是一种联吡啶类除草剂。经呼吸道吸入、消化道和皮肤吸收后可对人体产生较强毒性,引起一系列并发症,包括急性呼吸窘迫、肺纤维化、肾功能衰竭、肝毒性等,口服致死率高达90%。临床针对PQ中毒尚无有效治疗措施,治愈率低,病死率高,给国家和人民带来沉重的社会和经济负担[2, 5]。肺部是PQ损害的主要靶器官,肺上皮细胞主动摄取并蓄积PQ,使肺组织内PQ浓度为血液浓度的10~90倍[13],导致肺上皮细胞受损、凋亡及炎性细胞大量浸润,进而引发广泛的肺间质纤维化,患者最终因呼吸衰竭而死亡[14]。目前PQ致肺纤维化的分子机制尚未完全阐明,EMT、炎症反应和氧化应激在其中均发挥重要作用[15],Wnt/β-catenin、PI3K/AKT、Notch和TGF-β/Smad等信号通路均可参与肺纤维化进程[5-9]。本研究发现,PQ可使16HBE(人肺上皮细胞系)Collagen I、Vimentin和α SMA的mRNA和蛋白水平显著上调(a:P < 0.05),Occludin和CK18的mRNA和蛋白水平显著下调;动物实验发现PQ可显著上调肺组织中Collagen I、Vimentin和α SMA的蛋白水平HE染色和免疫组织化学提示PQ能够引起肺泡壁增厚,导致肺组织结构紊乱,造成肺损伤;提示PQ可诱导肺上皮细胞EMT发生,从而诱发肺纤维化。
miRNAs是存在于真核细胞中的一类内源性非编码单链小分子RNA,长约18-25个核苷酸(nucletide,nt),主要通过靶向靶基因mRNA的3’端非翻译区(3’ UTR)来调节靶基因表达,从而参与细胞分化、增殖、凋亡、组织损伤修复等生理病理进程[10, 16]。越来越多的研究表明miRNAs可参与上皮细胞EMT发生,在肺纤维化进程中发挥着重要的调控作用。Kuse等[11]发现外泌体来源的miRNA-22通过调节成纤维细胞向肌成纤维细胞分化进程以改善肺纤维化。Cao等[17]发现miR-200b/c可通过p38 MAPK和TGF-β/smad3信号通路靶向ZEB1/2,减轻脂多糖诱导的早期肺纤维化。Zhao等[12]在PQ诱导的小鼠肺泡上皮细胞(MLE-12)中,筛选出11条差异表达的miRNAs。本研究借助高通量芯片技术在PQ诱导的人肺上皮细胞损伤模型中筛选并验证出10条表达差异显著的miRNAs,选择显著下调的miR-15a-5p进行研究,发现miR-15a-5p可与Wnt3α基因3’ UTR区的碱基互补配对,负向调节Wnt3α基因的表达。
Wnt蛋白是一类分泌型糖蛋白,是Wnt/β-catenin信号通路的启动因子。不同的Wnt蛋白与膜上Fzd(Frizzled)家族受体结合,引起Axin-GSK-3β-APC复合物分解,促进β-catenin在胞质内大量积聚并入核,入核后结合转录因子TCF,调控下游靶基因的表达。Gao等[18]发现牛蒡子苷元可通过调控Wnt3α/β-catenin通路抑制PQ诱导的肺纤维化中的EMT进程。Ming等[19]发现PXR通过与p53相互作用抑制Wnt7a/β-catenin信号通路缓解肾纤维化。Yang等[20]发现抑制Wnt10b/β-catenin信号通路可减轻PQ诱导的肺纤维化。本研究发现,PQ导致miR-15a-5p表达水平显著下调,其靶基因Wnt3α表达水平显著上调,Wnt3α/β-catenin通路高度激活,促进肺上皮细胞EMT,最终导致肺纤维化。而过表达miR-15a-5p可抑制Wnt3α的表达,特异性降低Wnt3α/β-catenin信号通路活性,抑制EMT进程,最终有效抑制肺纤维化进程。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王静、姬晓航:实验操作、论文撰写;王蒙蒙、张炜、冯靖:研究设计与实施指导;丁伟超、陈娟、孟健康:数据收集整理与统计分析;聂时南、孙兆瑞:研究设计、论文修改经费与技术支持
| [1] | Zhang ZQ, Nian Q, Chen G, et al. Klotho alleviates lung injury caused by paraquat via suppressing ROS/P38 MAPK-regulated inflammatory responses and apoptosis[J]. Oxid Med Cell Longev, 2020, 2020: 1854206. DOI:10.1155/2020/1854206 |
| [2] | 王蒙蒙, 杨志洲, 任艺, 等. DDK1阻断Wnt/β-catenin信号通路抑制百草枯诱导的肺成纤维细胞转分化[J]. 中华急诊医学杂志, 2022, 31(03): 310-314. DOI:10.3760/cma.j.issn.1671-0282.2022.03.009 |
| [3] | 中国医师协会急诊医师分会. 急性百草枯中毒诊治专家共识(2022)[J]. 中华急诊医学杂志, 2022, 31(11): 1435-1444. DOI:10.3760/cma.j.issn.1671-0282.2022.11.001 |
| [4] | 曹丽萍, 温彦芳, 曹昌魁, 等. 血必净对百草枯中毒大鼠肺组织Caspase-3表达及血浆炎症因子的影响[J]. 中华急诊医学杂志, 2018, 27(10): 1121-1125. DOI:10.3760/cma.j.issn.1671-0282.2018.10.012 |
| [5] | Li XH, Liu XW, Deng RX, et al. Betulinic acid attenuated bleomycin-induced pulmonary fibrosis by effectively intervening Wnt/β-catenin signaling[J]. Phytomedicine, 2021, 81: 153428. DOI:10.1016/j.phymed.2020.153428 |
| [6] | Sun ZR, Yang ZZ, Wang MM, et al. Paraquat induces pulmonary fibrosis through Wnt/β-catenin signaling pathway and myofibroblast differentiation[J]. Toxicol Lett, 2020, 333: 170-183. DOI:10.1016/j.toxlet.2020.08.004 |
| [7] | Wang JC, Hu KL, Cai XY, et al. Targeting PI3K/AKT signaling for treatment of idiopathic pulmonary fibrosis[J]. Acta Pharm Sin B, 2022, 12(1): 18-32. DOI:10.1016/j.apsb.2021.07.023 |
| [8] | Huang RX, Bai CJ, Liu XD, et al. The p53/RMRP/miR122 signaling loop promotes epithelial-mesenchymal transition during the development of silica-induced lung fibrosis by activating the Notch pathway[J]. Chemosphere, 2021, 263: 128133. DOI:10.1016/j.chemosphere.2020.128133 |
| [9] | Liu L , Liu B , Li L ,et al. Effects of resveratrol on pulmonary fibrosisvia tgf-beta/smad/erk signaling pathway[J]. Am J Chin Med,2023,51(3):1-26. DOI:10.1142/S0192415X23500313 |
| [10] | Ghafouri-Fard S, Abak A, Talebi SF, et al. Role of miRNA and lncRNAs in organ fibrosis and aging[J]. Biomed Pharmacother, 2021, 143: 112132. DOI:10.1016/j.biopha.2021.112132 |
| [11] | Kuse N, Kamio K, Azuma A, et al. Exosome-derived microRNA-22 ameliorates pulmonary fibrosis by regulating fibroblast-to-myofibroblast differentiation in vitro and in vivo[J]. J Nippon Med Sch, 2020, 87(3): 118-128. DOI:10.1272/jnms.JNMS.2020_87-302 |
| [12] | Zhao HW, Liu H, Liu LY, et al. Analysis of microRNA expression profiling during paraquat-induced injury of murine lung alveolar epithelial cells[J]. J Toxicol Sci, 2020, 45(8): 423-434. DOI:10.2131/jts.45.423 |
| [13] | Buendía JA, Justinico Castro JA, Vela LJT, et al. Comparison of four pharmacological strategies aimed to prevent the lung inflammation and paraquat-induced alveolar damage[J]. BMC Res Notes, 2019, 12(1): 584. DOI:10.1186/s13104-019-4598-0 |
| [14] | Zhang J, Li WJ, Chen SQ, et al. Mutual promotion of mitochondrial fission and oxidative stress contributes to mitochondrial-DNA-mediated inflammation and epithelial-mesenchymal transition in paraquat-induced pulmonary fibrosis[J]. World J Emerg Med, 2023, 14(3): 209-216. DOI:10.5847/wjem.j.1920-8642.2023.057 |
| [15] | Liu C, Sun ZR, Wang MM, et al. Arctigenin attenuates paraquat-induced human lung epithelial A549 cell injury by suppressing ROS/p38 mitogen-activated protein kinases-mediated apoptosis[J]. World J Emerg Med, 2022, 13(5): 373-378. DOI:10.5847/wjem.j.1920-8642.2022.086 |
| [16] | 秦晓梦, 任国庆. miRNA作为脓毒症及其并发症生物标志物的研究进展[J]. 医学综述, 2021, 27(19): 3796-3801. DOI:10.3969/j.issn.1006-2084.2021.19.010 |
| [17] | Cao YM, Liu YJ, Ping F, et al. MiR-200b/c attenuates lipopolysaccharide-induced early pulmonary fibrosis by targeting ZEB1/2 via p38 MAPK and TGF-β/smad3 signaling pathways[J]. Lab Invest, 2018, 98(3): 339-359. DOI:10.1038/labinvest.2017.123 |
| [18] | Gao F, Zhang Y, Yang ZZ, et al. Arctigenin suppressed epithelial-mesenchymal transition through Wnt3α/β-catenin pathway in PQ-induced pulmonary fibrosis[J]. Front Pharmacol, 2020, 11: 584098. DOI:10.3389/fphar.2020.584098 |
| [19] | Ming WH, Luan ZL, Yao Y, et al. Pregnane X receptor activation alleviates renal fibrosis in mice via interacting with p53 and inhibiting the Wnt7a/β-catenin signaling[J]. Acta Pharmacol Sin, 2023, 44(10): 2075-2090. DOI:10.1038/s41401-023-01113-7 |
| [20] | Yang ZZ, Wang MM, Ren Y, et al. Inhibition of Wnt10b/β-catenin signaling alleviates pulmonary fibrogenesis induced by paraquat in vivo and in vitro[J]. Life Sci, 2021, 286: 120027. DOI:10.1016/j.lfs.2021.120027 |
 2024, Vol. 33
2024, Vol. 33




